
【题目】在标准状况下,将224.00L氯化氢气体溶于635.00mL的水(密度为1.00g/cm3)中,所得盐酸的密度为1.18g/cm3 . (要求有解题过程)
(1)该盐酸的质量分数是多少?
(2)取这种盐酸100.00mL,稀释到500.00mL,所得的稀盐酸的物质的量浓度为多少?
【答案】
(1)解:224L氯化氢气体物质的量为 ![]() =10mol,故HCl的质量=10mL×36.5g/mol=365g,水的质量为635mL×1g/mL=635g,
=10mol,故HCl的质量=10mL×36.5g/mol=365g,水的质量为635mL×1g/mL=635g,
该溶液质量分数为 ![]() ×100%=36.5%,
×100%=36.5%,
答:该盐酸中溶质的质量分数是36.5%
(2)解:溶液的体积为 ![]() =
= ![]() L,该盐酸的物质的量浓度为
L,该盐酸的物质的量浓度为 ![]() =11.8mol/L;
=11.8mol/L;
令稀释后,所得稀盐酸的物质的量浓度为cmol/L,根据稀释定律,稀释前后溶质的物质的量不变,则:
0.1L×11.8mol/L=0.5L×cmol/L,
解得c=2.36L,
答:所得稀盐酸的物质的量浓度是2.36L
【解析】根据n= ![]() 计算224L氯化氢气体物质的量,再根据m=nM计算HCl的质量,根据m=ρV计算水的质量,(1)根据w=
计算224L氯化氢气体物质的量,再根据m=nM计算HCl的质量,根据m=ρV计算水的质量,(1)根据w= ![]() ×100%;(2)先计算出盐酸的物质的量浓度,再根据稀释定律,稀释前后溶质的物质的量不变计算.
×100%;(2)先计算出盐酸的物质的量浓度,再根据稀释定律,稀释前后溶质的物质的量不变计算.


科目:高中化学 来源: 题型:
【题目】下列反应中.氧化反应与还原反应在同一种元素中进行的是 ( )
A.Zn+H2SO4═ZnSO4+H2↑
B.2FeCl2+Cl2═2FeCl3
C.2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
D.Cl2+H2O═HClO+HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度时,1L密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g) △H=-196kJ/mol,数据:
2SO3(g) △H=-196kJ/mol,数据:
反应时间/min | n(SO2)/mol | n(O2)/mol |
0 | 2 | 1 |
5 | 1.2 | |
10 | 0.4 | |
15 | 0.8 |
下列说法不正确的是
A. 反应在前5min的平均速率为v (SO2)=0.08mol·L1 min1
B. 保持温度不变,向平衡后的容器中再充入0.2molSO2和0.1molO2时,v (正)> v (逆)
C. 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D. 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在常温常压(或稍低温度)下合成,其熔点-64.5℃,沸点-5.5℃,遇水易水解。实验室模拟制备装置如图所示(部分夹持装置省略),D中三颈烧瓶置于-10℃冰盐水中。
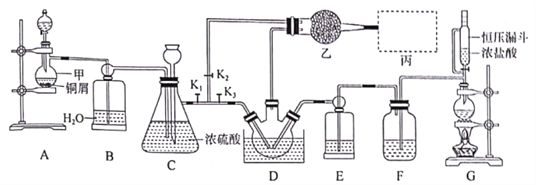
经查阅资料,相关物质性质如下:
①NO2熔点-64.5℃,沸点-5.5℃,可发生反应Cl2+2NO2=2NClO2
②NO与NaOH溶液不反应,但NO2+NO+2NaOH =2NaNO2+H2O
(1)仪器甲的名称是__________。
(2)图示装置中恒压漏斗与分液漏斗相比,其优点为_________________。
(3)NOC1分子中各原子均满足8电子稳定结构,则NOCl的电子式为_________。
(4)实验开始时,先打开K1、K2,关闭K3,打开分液漏斗活塞滴人适量稀硝酸,至C中红棕色完全消失后,关闭K1、K2,此时装置C的作用为_________ ;滴入适量浓盐酸,点燃酒精灯,当______(填装置符号)中充满黄绿色气体时,打开K1、K3,制备NOCl。
(5)装置乙中装有无水CaCl2,其作用为____________;丙为尾气处理装置,则最佳选择为_________。

(6)若实验开始时,先关闭K2,打开K1、K3 ,使NO与Cl2直接反应制备NOC1,会引起什么后果________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】体积相同、pH相同的HCl溶液和CH3COOH溶液,与NaOH溶液中和时,两者消耗NaOH的物质的量( )
A.无法比较B.相同C.中和HCl的多D.中和CH3COOH的多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A和2 mol B放入2 L密闭容器中发生反应2A(g) + B(g) ![]() 2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
A.4 s内,υ(B)=0.075 mol/(L ·s)
B.当c(A)︰c(B)︰c(C)=2︰1︰2 时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子,能大量共存于同一溶液中的是( )
A. CO32-、H+、Na+、NO3- B. H+、Ag+、Cl-、SO42-
C. K+、Na+、OH-、NO3- D. Ba2+、Ca2+、SO42-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A、B、C、D分别为AlCl3、NaOH、NH4HSO4、Na2CO3溶液,实验过程和记录如下图所示(无关物质已经略去):
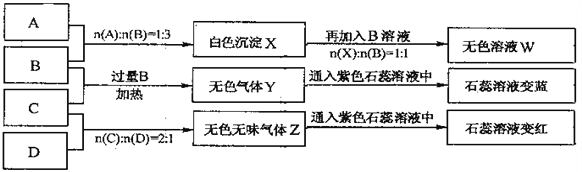
请回答:
(1)W的溶液加热蒸干并灼烧最后所得固体为__________。
(2)D溶液pH___(填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示)_______。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是_________。(用化学式表示)
(4)等物质的浓度的C溶液与NH4Cl溶液相比较,c(NH4+):前者_____后者(填“<”“>”“=”)。
(5)若B、C的稀溶液混合后(不加热)溶液呈中性,则该溶液中离子浓度从大到小的顺序是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵[(NH4)2Fe(SO4)2]是分析化学中的重要试剂,在不同温度下加热分解产物不同。设计如图实验装置(夹持装置略去),在500℃时隔绝空气加热A中的硫酸亚铁铵至分解完全,确定分解产物的成分。

(1)B装置的作用是___________________。
(2)实验中,观察到C中无明显现象,D中有白色沉淀生成,可确定产物中一定有_______气体产生,写出D中发生反应的离子方程式_______。若去掉C,是否能得出同样结论并解释其原因______________。
(3)A中固体完全分解后变为红棕色粉末,某同学设计实验验证固体残留物仅为Fe2O3,而不含FeO,请完成表中内容。(试剂,仪器和用品自选)
实验步骤 | 预期现象 | 结论 |
取少量A中残留物于试管中,加入适量稀硫酸,充分振荡使其完全溶解;___________ | ____________________ | 固体残留物仅为Fe2O3 |
(4)若E中收集到的气体只有N2,其物质的量为x mol,固体残留物Fe2O3,的物质的量为y mol,D中沉淀物质的量为z mol,根据氧化还原反应的基本规律,x、y和z应满足的关系为______________。
(5)结合上述实验现象和相关数据的分析,完成硫酸亚铁铵[(NH4)2Fe(SO4)2]在500℃时隔绝空气加热完全分解的化学方程式__________________。
(6)用氧化还原滴定法测定制备得到的TiO2试样中的TiO2的质量分数:在一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作为指示剂,用硫酸铁铵[NH4Fe(SO4)2]标准溶液滴定Ti3+至全部生成Ti4+。
①TiCl4水解生成TiO2·xH2O的化学方程式为_______________。
②滴定终点的现象是_______________。
③滴定分析时,称取TiO2试样0.2 g,消耗0.1 mol·L-1NH4Fe(SO4)2标准溶液20mL,则TiO2的质量分数为_______________。
④若在滴定终点读取滴定管刻度时,俯视标准溶液的液面,使其测定结果_______(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com