
【题目】将4 mol A和2 mol B放入2 L密闭容器中发生反应2A(g) + B(g) ![]() 2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
2C(g) ΔH<0。4 s后反应达到平衡状态,此时测得C的浓度为0.6 mol/L。下列说法正确的是
A.4 s内,υ(B)=0.075 mol/(L ·s)
B.当c(A)︰c(B)︰c(C)=2︰1︰2 时,该反应即达到平衡状态
C.达到平衡状态后,若只升高温度,则C的物质的量浓度增大
D.达到平衡状态后,若温度不变,缩小容器的体积,则A的转化率降低
 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
【题目】Mg、Al、Fe三种金属的混合物与足量的稀硫酸反应,生成2.80 L H2(标准状况),则三种金属的物质的量之和不可能是( )
A. 0.120 mol B. 0.110 mol C. 0.080 mol D. 0.100 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.工业上利用反应ZnFe2 (C2O4)3·6H2O![]() ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4。
ZnFe2O4+2CO2↑+4CO↑+6H2O制备ZnFe2O4。
(1)ZnFe2O4中Fe的化合价为___________。
(2)该反应中还原产物是________(填化学式),每生成1mol ZnFe2O4,转移的电子数为________。
Ⅱ.在pH=l的某溶液X中仅含有NH4+、Al3+、Ba2+、Fe2+、Fe3+、CO32-、SO42-、Cl-、NO3-中的一种或几种(忽略水的电离及离子的水解),取该溶液进行连续实验,实验过程如图:
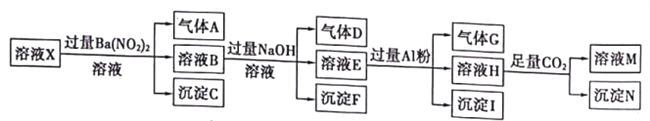
已知:NO3-+Al+OH-+H2O→NH4++[Al(OH)4]-
(1)溶液X中除H+外,一定存在的离子是_________________。
(2)写出生成沉淀N的离子方程式_________________。
(3)若取原溶液X少许直接加入AgNO3溶液产生白色沉淀,则确定该溶液中一定含有Cl-,你认为这种说法是否合理。_______(填“是”或“否”),其理由是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】使用哪组试剂,可鉴别在不同试剂瓶内的1-己烯、甲苯和丙醛
A.酸性KMnO4溶液和溴的CCl4溶液
B.银氨溶液和溴的CCl4溶液
C.FeCl3溶液和银氨溶液
D.银氨溶液和酸性KMnO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将224.00L氯化氢气体溶于635.00mL的水(密度为1.00g/cm3)中,所得盐酸的密度为1.18g/cm3 . (要求有解题过程)
(1)该盐酸的质量分数是多少?
(2)取这种盐酸100.00mL,稀释到500.00mL,所得的稀盐酸的物质的量浓度为多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化镁溶液的密度为1.18gcm﹣3 , 其中镁离子的质量分数为5.1%,则300mL该溶液中Cl﹣的物质的量约等于( )
A.0.37 mol
B.0.63 mol
C.0.74 mol
D.1.50 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠(NaCN)是一种重要的化工原料,用于电镀、冶金和有机合成医药,农药及金属处理等方面。已知:氰化钠为白色结晶颗粒或粉末,易潮解,有微弱的苦杏仁气味,剧毒。熔点563.7℃,沸点1496℃。易溶于水,易水解生成氰化氢,水溶液呈强碱性。
(1)氰化钠中碳元素的化合价+2价,N元素显-3价,则非金属性N__________C(填<,=或 >),用离子方程式表示NaCN溶液呈强碱性的原因:____________________。
(2)己知:
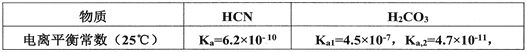
则向NaCN溶液通入少量CO2反应的离子方程式:____________________
(3)用如图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液PH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法错误的是________________。
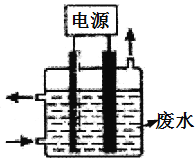
A.除去CN-的反应:2CN-+5ClO-+2H+=N2↑+2CO2↑+5Cl-+H2O
B.用石墨作阳极,铁作阴极
C.阴极的电极反应式为:2H2O+2e-=H2↑+2OH-
D.阳极的电极反应式为:Cl-+2OH--2e-=ClO-+H2O
(4)氰化钠可用双氧水进行消毒处理。
用双氧水处理氰化钠产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,请写出该反应的化学方程式____________________;
(5)化合物(CN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素,试写出(CN)2与NaOH溶液反应的化学方程式:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.1 mol/L HCl溶液滴定10 mL 0.1 mol/L Na2CO3溶液,滴定曲线如图所示。下列说法正确的是( )

A. 水电离程度由大到小的顺序为:a>b>c>d
B. a点时:c(Na+)>c(CO![]() )>c(HCO)>c(OH-)
)>c(HCO)>c(OH-)
C. b点时:3c(Na+)=2c(CO![]() )+2c(HCO)+2c(H2CO3)
)+2c(HCO)+2c(H2CO3)
D. d点时:c(H+)>c(HCO)=c(CO![]() )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com