
【题目】下列各组粒子中属于同位素的是( )
A. 16O和18O B. H2O和D2O C. H2和D2 D. 24Mg和24Na
科目:高中化学 来源: 题型:
【题目】除去空气中的二氧化硫和氨氧化物气体对环境保护有重要意义。
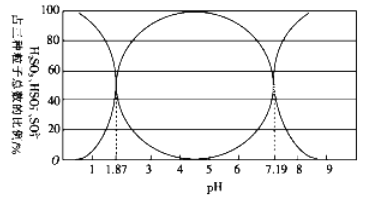
(1)二氧化硫易溶于水,溶于水后所得溶液中H2SO3、HSO3-和SO32- 占三种粒子总数的比例随pH的变化如下图所示。由图可知H2SO3 的电离平衡常数Ka1=____________。
(2)利用尿素[CO(NH2)2]水解的溶液可以吸收含SO2 的空气。已知尿素水解放热,常温下水解反应较慢,水解的反应方程式如下:CO(NH2)2+H2O=H2NCOONH4(氨基甲酸铵)。
①氨基甲酸铵会与空气中的SO2 和O2 反应生成(NH4)2SO4,该反应的化学方程式为__________。
②一定条件下,用尿素溶液吸收含SO2 的空气,测得SO2 的吸收率随溶液的温度变化如图甲所示。温度高于60 ℃时,SO2 的吸收率逐渐升高的原因是_____________。
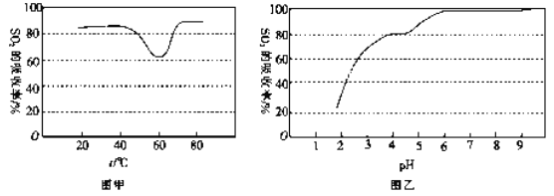
③尿素溶液吸收SO2 的吸收率随溶液的pH变化如图乙所示。尿素溶液吸收含SO2的空气后溶液的pH会降低,为提高SO2 的吸收率和充分回收产物,最好向溶液中加入_____(填溶液的名称)并控制pH 为_______。
(3)一种电化学脱硝法的原理如图所示。
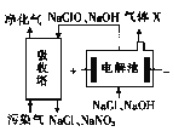
①电解池阴极所发生的电极反应为_____________。
②相同条件下通入的污染气和生成的X 的体积比为40 :3,污染气中NO 和NO2 占总体积的10%,若NaClO完全反应,污染气中NO和NO2 被完全吸收且其余气体不参与反应,则NO和NO2 的体积比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、 D、E、F 原子序数依次增大的六种元素,它们位于元素周期表的前四周期。A元素能级数与核外电子数相等;B 元素含有3个能级,且每个能级所含的电子数相同;D 的原子核外有8 个运动状态不同的电子,E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E 元素的基态原子有4 个未成对电子。请回答下列问题:
(1)请写出D 基态的价层电子排布图_______________。
(2)下列说法错误的是______________。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点: SiO2>CO2
B.电负性顺序: C
C.N 2 与CO 为等电子体,结构相以,化学性质相似
D.稳定性:H2O>H2S,原因是水分子间存在氢键
(3)某化合物与F(I)(I 表示化合价为+1)结合形成下图所示的离子,该离子中碳原子的杂化方式是______。

(4)己知(BC)2 是直线性分子,并有对称性,且分子中每个原子最外层都达到8电子稳定结构,则(BC)2中σ键和π键的个数比为_________________。
(5) C元素最高价含氧酸与硫酸酸性强度相近,原因是______________。
(6) B单质的一种的晶体结构如图所示,则一个晶胞中所含B 原子数为__________;其中原子坐标参数a 为0,0,0), b 为(1/2,1/2,0),则c点原子的坐标参数为______________。

(7)D与F 形成离子个数比为1:1的化合物,晶胞与NaCl类似,D 离子的配位数是______;设D离子的半径为apm,F离子的半径为bpm,求该晶胞的空间利用率为__________(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的由Cu和Cu2O组成的混合粉末加入到125 mL 2.6 mol·L-1的硝酸中,固体恰好完全溶解,得蓝色溶液X并收集到V mL(标准状况)的纯净无色气体Y。下列结论正确的是( )
A. X中有两种溶质
B. Y通入纯水中得到酸性溶液
C. 原混合粉末的总质量小于7.8 g
D. 当V=1 680时,原混合粉末中Cu和Cu2O的物质的量之比为8∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某课外活动小组为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图1所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉.
请回答下列问题
(1)对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签如图2.浓硫酸的危险警告标签是 .
(2)装置A中发生反应的化学方程式为 .
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是(用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为;
(5)当D中产生现象时,可以说明使E中澄清石灰水变浑浊的是CO2 , 而不是SO2;写出D中发生反应的化学方程式,并标出电子转移方向和数目 .
(6)Ⅱ. Cu与浓硫酸反应可得硫酸铜溶液.某学习小组将铜屑放入一定浓度的硫酸中,加热并不断鼓入空气也可得硫酸铜溶液,其反应原理为2Cu+O2+2H2SO4═2CuSO4+2H2O.现欲将12.8g铜完全溶解,加蒸馏水后得200mL溶液.计算:
参加反应的氧气在标准状况下的体积是L.(不必写计算过程)
(7)所得硫酸铜溶液的物质的量浓度是mol/L(不必写计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是制取、净化并测量生成气体体积的装置示图。利用如图装置进行下表所列实验,能达到实验目的的是
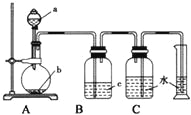
选项 | a(液体) | b(固体) | c(液体) |
A | 饱和食盐水 | 电石 | 硫酸铜溶液 |
B | 浓氨水 | 生石灰 | 浓硫酸 |
C | 稀硫酸 | 硫化亚铁 | 浓硫酸 |
D | 浓硫酸 | Cu片 | 氢氧化钠溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙酮酸是医药合成中的一种重要中间体,某研究小组对苯乙酮酸展开如下设计研究:

已知:I. ![]() II.
II. ![]()
请回答:
(1)下列说法正确的是_____________;
A.反应①②④都是取代反应 B.化合物C能发生消去反应
C.化合物D中含有两种官能团 D.化合物E的分子式为C17H25NO3
(2)反应④D→E的化学方程式是___________________________________。
(3)化合物M的结构简式是___________________________。
(4)写出同时符合下列条件的化合物 的所有同分异构体的结构简式____________。
的所有同分异构体的结构简式____________。
①能发生银镜反应
②1H-NMR谱显示分子中有三种不同化学环境的氢原子。
(5)采用甲苯为原料制备苯乙酮酸(![]() ),请设计该合成路线(用流程图表示,无机试剂任选)_____。
),请设计该合成路线(用流程图表示,无机试剂任选)_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na+浓度为1.0 molL-1的某澄清溶液中,还可能含有K+、Mg2+、Fe3+、Ba2+、CO32-、SO32-、SiO32-、Cl-、SO42-等离子,取该溶液100mL 进行下图连续实验(所加试剂均过量,气体全部逸出)。下列说法不正确的是

A. 原溶液中一定不存在Mg2+、Fe3+、Ba2+、SO42-
B. 在l00mL原溶液中加入足量BaCl2溶液,至少可生成沉淀20.5g
C. 为确定原溶液中是否含有Cl-,可取滤液C,加入AgNO3和稀HNO3溶液
D. 原溶液一定存在K+,c(K+)可能为1.5 molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在1273 K时,有如下反应:FeO(s) + CO(g) ![]() Fe(s) + CO2(g) K = 0.5
Fe(s) + CO2(g) K = 0.5
(1)、请写出求此反应平衡常数K的数学表达式:K=_____________________。
(2)、如果CO和CO2的起始浓度为下列数值:c (CO) = 0.05 mol·L--1 ,c (CO2) = 0.01 mol·L--1 ,求它们的平衡浓度_________。(写出计算过程)
(3)、平衡时,求CO的转化率为________________(不用写计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com