
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正化合价与最低负化合价之和为零 |


科目:高中化学 来源: 题型:阅读理解
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正化合价与最低负化合价之和为零 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江西省会昌中学高一第二学期第一次月考化学试卷 题型:填空题
(6分)已知四种短周期元素形成的离子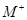 、
、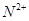 、
、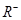 、
、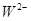 具有相同的电子层结构。(用推断出的元素符号表示)
具有相同的电子层结构。(用推断出的元素符号表示)
①M、N、R、W的原子序数由大到小的顺序是 。
②M、N、R、W的原子半径由大到小的顺序是 。
③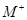 、
、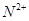 、
、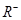 、
、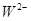 的离子半径由大到小的顺序是? ?。
的离子半径由大到小的顺序是? ?。
查看答案和解析>>
科目:高中化学 来源:2014届江西省高一第二学期第一次月考化学试卷 题型:填空题
(6分)已知四种短周期元素形成的离子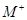 、
、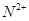 、
、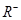 、
、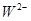 具有相同的电子层结构。(用推断出的元素符号表示)
具有相同的电子层结构。(用推断出的元素符号表示)
①M、N、R、W的原子序数由大到小的顺序是 。
②M、N、R、W的原子半径由大到小的顺序是 。
③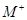 、
、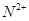 、
、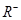 、
、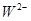 的离子半径由大到小的顺序是?
?。
的离子半径由大到小的顺序是?
?。
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| W | X | Y | Z | |
| 结构或性质 | 最高价氧化物对应的水化物与其气态氢化物反应得到离子化合物 | 焰色反应呈黄色 | 在同周期主族元素形成的简单离子中,离子半径最小 | 最高正化合价与最低负化合价之和为零 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com