
 某化学兴趣小组用以下装置探究SO2的某些化学性质.
某化学兴趣小组用以下装置探究SO2的某些化学性质.分析 (1)亚硫酸钠和70%硫酸反应生成硫酸钠、SO2和水;
(2)SO2有毒不能直接排空,SO2属于酸性氧化物,能被碱性物质吸收;
(3)SO2能使有色物质变为无色而体现漂白性;
SO2和Na2S发生氧化还原反应生成S单质;
若X为含有H2O2和BaCl2的混合溶液,可观察到有白色沉淀生成,发生的反应为
SO2+H2O2+BaCl2=BaSO4↓+2HCl,则生成的白色沉淀的硫酸钡.
解答 解:(1)根据强酸制取弱酸原理知,亚硫酸钠和70%硫酸反应生成硫酸钠、SO2和水,反应方程式为H2SO4+Na2SO3=Na2SO4+H2O+SO2↑,故答案为:H2SO4+Na2SO3=Na2SO4+H2O+SO2↑;
(2)SO2有毒不能直接排空,SO2属于酸性氧化物,能被碱性物质吸收,所以乙装置作用吸收尾气,防止污染空气,故答案为:吸收尾气,防止污染空气;
(3)SO2能和品红溶液反应生成无色物质而体现漂白性,该实验说明二氧化硫具有漂白性;
SO2和Na2S发生氧化还原反应生成S单质,该反应二氧化硫中S元素化合价由+4价变为0价,则二氧化硫体现氧化性;
若X为含有H2O2和BaCl2的混合溶液,可观察到有白色沉淀生成,发生的反应为
SO2+H2O2+BaCl2=BaSO4↓+2HCl,则生成的白色沉淀的硫酸钡,该反应中S元素化合价由+4价变为+6价,二氧化硫体现还原性,
故答案为:a;c;b.
点评 本题以二氧化硫为载体考查无机实验方案设计,为高频考点,明确二氧化硫性质及实验原理是解本题关键,注意从实验原理、物质检验、尾气处理等方面分析解答,题目难度不大.


 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:选择题
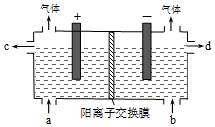 用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是( )
用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是( )| A. | 通电后阳极区溶液pH增大 | |
| B. | 阴极区的电极反应式为4OH--4e-=O2↑+2H2O | |
| C. | 当电路中通过1mol电子的电量时,会有0.25mol的Cl2生成 | |
| D. | 通电后Li+通过交换膜向阴极区迁移,LiOH浓溶液从d口导出 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molKClO4 | B. | 0.1molKClO3 | C. | 0.2molKClO2 | D. | 0.1molKClO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 序号 | 实验步骤和结论 |
| ① | 比较浓度均为0.1mol•L-1的A和E的pH的大小为:7<A<E |
| ② | 1L pH=9的A分别与x L 0.001mol•L-1 B,y L 0.001mol•L-1D充分反应后,当溶液均呈中性时x、y的大小关系为:y<x; |
| ③ | pH=a的C与pH=b的D,且a+b=14,等体积混合发生酸碱中和反应后,溶液呈碱性. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径大小顺序:r(Z2+)>r(Y2-) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应的水化物的酸性比W的强 | |
| D. | 单质的熔点Z>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:Z>Y>X | B. | 氢化物的稳定性:Z>X | ||
| C. | Z的最高价氧化物可用于漂白 | D. | X与Y形成的化合物为离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向盛有某溶液的试管中加入盐酸酸化的硝酸钡,产生白色沉淀,则该溶液中一定含SO42- | |
| B. | 向盛有某溶液的试管中加入浓的强碱溶液,加热,用润湿的蓝色石蕊试纸置于管口,试纸变红,则该溶液中一定含有NH4+ | |
| C. | 向盛有某溶液的试管中加入硝酸银溶液,产生了白色沉淀,则该溶液中一定含有Cl- | |
| D. | 向盛有某溶液的试管中加入加入KSCN溶液显红色.则该溶液中一定含有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2010 年 11 月广州亚运会燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 | |
| B. | 合金的硬度一般比它的各成分金属的小,多数合金的熔点一般也比它的各成分金属 的高 | |
| C. | 小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 | |
| D. | 青铜是我国使用最早的合金材料,目前世界上使用量最大的合金材料是钢铁 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com