
| A. | 简单离子半径:Z>Y>X | B. | 氢化物的稳定性:Z>X | ||
| C. | Z的最高价氧化物可用于漂白 | D. | X与Y形成的化合物为离子化合物 |
分析 短周期元素X、Y、Z的原子序数依次递增,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍,则X的内层电子数为2,Z的最外层电子数为6,Y的最外层电子数为2,原子的最外层电子数之和为13,则X的最外层电子数为13-6-2=5,所以X为N,Y为Mg,Z为S,结合元素及其化合物来解答.
解答 解:短周期元素X、Y、Z的原子序数依次递增,Z原子最外层电子数是X原子内层电子数的3倍或者Y原子最外层电子数的3倍,则X的内层电子数为2,Z的最外层电子数为6,Y的最外层电子数为2,原子的最外层电子数之和为13,则X的最外层电子数为13-6-2=5,所以X为N,Y为Mg,Z为S,
A.电子层越多,离子半径越大,具有相同电子排布的离子,原子序数大的离子半径小,则离子半径为Z>X>Y,故A错误;
B.X为N、Z为S,氢化物分别为氨气、硫化氢,氨气的稳定性较强,即氢化物的稳定性:Z<X,故B错误;
C.Z为S元素,其最高价氧化物为三氧化硫,三氧化硫不具有漂白性,故C错误;
D.X为N,Y为Mg,二者形成的化合物为氧化镁,MgO为离子化合物,故D正确;
故选D.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,利用原子结构来推断元素是解答本题的关键,注意短周期元素的内层电子只能为2或8,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:实验题
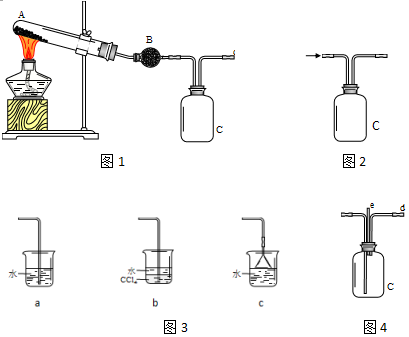
 某化学兴趣小组用以下装置探究SO2的某些化学性质.
某化学兴趣小组用以下装置探究SO2的某些化学性质.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
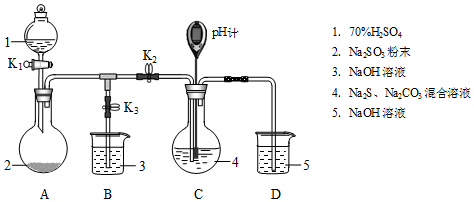
| 操作步骤 | 装置C的实验现象 | 解释原因 |
| 检查装置气密性后,添加药品 | pH计读数约为13 | 用离子方程式表示(以S2-为例): S2-+H2O?HS-+OH- |
| 打开K2,关闭K3,调节K1使硫酸缓慢匀速滴下 | ⅰ.导管口有气泡冒出,溶液出现淡黄色浑浊,然后逐渐澄清(或浑浊减少); ⅱ.pH计读数逐渐 减小 | 反应分步进行: Na2CO3+SO2═Na2SO3+CO2 2Na2S+3SO2═2Na2SO3+3S↓ Na2SO3+S═Na2S2O3(较慢) |
| 当pH计读数接近7时,立即停止通SO2,操作是关闭K1、K2,打开K3 | / | 必须立即停止通SO2的原因是: SO2过量会使溶液酸度增加,使产物分解,降低产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2NH3+3CuO $\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O | B. | 3NO2+H2O═2HNO3+NO | ||
| C. | 4HNO3(浓)$\frac{\underline{\;光照\;}}{或△}$4NO2↑+O2↑+2H2O | D. | N2+O2 $\frac{\underline{\;放电\;}}{\;}$ 2NO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(D)=0.05mol/(L•min) | B. | 3v(B)=2v(C) | ||
| C. | v(B)=0.15mol/(L•min) | D. | A的转化率为40% |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| ① | ② | ③ | ④ | |
| I | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 硅胶 | 浓硫酸 | 无水氯化钙 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com