
| A、加入苯酚显紫色的溶液;K+、NH+4、Cl-、I- |
| B、pH=12的溶液:Na+、Ca2+、HCO-3、Cl- |
| C、水电离出的c(H+)=10-12mo1?L-1的溶液:K+、Ba2+、Cl-、Br- |
| D、0.1 mol?L-1的Cu(NO3)2溶液:Na+、K+、S2-、SO2-4- |


科目:高中化学 来源: 题型:
| A、苯和浓溴水用铁做催化剂制溴苯 |
| B、将苯与浓硝酸混合共热制硝基苯 |
| C、甲烷与氯气光照制得纯净的一氯甲烷 |
| D、乙烯通入溴的四氯化碳溶液得到1,2-二溴乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 |
| B、金属钠着火燃烧时,用泡沫灭火器灭火 |
| C、用碳单质还原氧化镁制取金属镁 |
| D、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
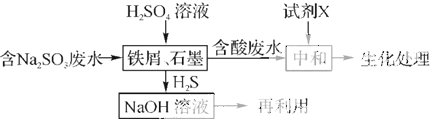
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(NO)?c(SO3) |
| c(NO2)?c(SO2) |
| A、反应的热化学方程式为NO2(g)+SO2(g)?NO(g)+SO3(g)△H>0 |
| B、一定条件下达到平衡时,缩小容器体积,增大体系压强,气体颜色加深 |
| C、混合气体的平均摩尔质量保持不变,说明反应已达平衡 |
| D、使用合适的催化剂可使该反应的反应速率和平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
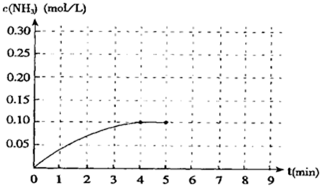
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水的离子积变大,PH变小,呈中性 |
| B、水的离子积不变,PH不变,呈中性 |
| C、水的离子积变小,PH变大,呈碱性 |
| D、水的离子积变大,PH变小,呈酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学键的断裂不一定引起化学反应 |
| B、金属阳离子还原不一定得到相应的金属单质 |
| C、根据分散质粒子直径的大小可以将分散系分为溶液,胶体和浊液 |
| D、如果某化学反应的△H和△S均大于0,则该反应肯定不能自发进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com