


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ba2+、Cl-、NO3-、Na+ |
| B、K+、Cu2+、SO42-、Cl- |
| C、Na+、K+、CO32-、SO42- |
| D、Mg2+、SO42-、OH-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | 250℃ | 300℃ | 350℃ |
| 平衡常数K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室将Na2SO3溶液直接加热蒸发结晶可得到Na2SO3晶体 |
| B、用湿润的pH试纸来检验溶液的pH值 |
| C、用KSCN溶液检验硫酸亚铁溶液是否氧化变质 |
| D、用四氯化碳萃取溴的苯溶液中的溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该条件下此反应的化学平衡常数约为0.91 |
| B、A的平均反应速率为0.3mol/(L?s) |
| C、B的转化率为40% |
| D、若混合气体的密度不再改变时,该反应不一定达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸和碱一定能发生中和反应 |
| B、同种元素的化合价越高氧化性一定越强 |
| C、某化合物如果不是电解质就一定是非电解质 |
| D、对于可逆反,温度升高则该反应的平衡常数一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
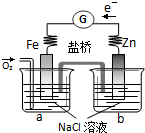
| A、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| B、烧杯a中发生反应O2+4H++4e-=2H2O,溶液pH升高 |
| C、烧杯b中发生的电极反应为Zn-2e-=Zn2+ |
| D、向烧杯a中加入少量K3Fe(CN)6溶液,有蓝色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发掉0.5L水 |
| B、标况下通入44.8L HCl气体 |
| C、将溶液加热蒸发浓缩至0.5L |
| D、加入10mol/L盐酸0.6L,再将溶液稀释至2L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com