
【题目】下列离子反应方程式正确的是( )
A.往FeCl3溶液中加入Fe粉:Fe3+ +Fe=2Fe2+
B.用CH3COOH溶解CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑
C.向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH![]()
D.碳酸氢钠溶液中加入过量石灰水:2HCO3-+Ca2++2OH-=CaCO3↓+CO![]() +2H2O
+2H2O
科目:高中化学 来源: 题型:
【题目】通过石油裂解制得A。以A为原料制取有机玻璃N及隐形眼镜材料M的合成路线如下:
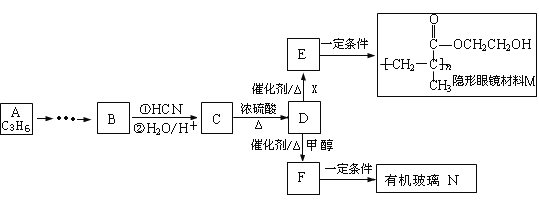
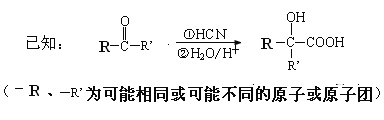
请回答:
(1)A中官能团的名称是 ,B的结构简式是 ,X中核磁共振氢谱峰面积比是 。
(2)F→N反应的化学方程式是 ,反应类型是 。
(3)C在一定条件下转化为高分子化合物的化学方程式是 。
(4)D有多种同分异构体,符合下列条件的有 种(包括顺反异构体)。
① 能发生银镜反应 ② 能与NaOH溶液反应
其中反式结构的结构简式是 。
(5)B是一种重要的工业溶剂,请完成A→B的反应的合成路线 (有机物写结构简式、无机试剂任选): 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z都是金属,把X投入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y为电池的负极,X、Y、Z三种金属的活泼性顺序为( )
A.X>Y>Z B.X>Z>Y C.Y>X>Z D.Y>Z>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源可分为一级能源和二级能源,自然界中以现成形式提供的能源称为一级能源,需依靠其他能源间接制取的能源称为二级能源。比如氢气就是一种高效而没有污染的二级能源。据此判断,下列叙述正确的是( )
A.天然气是二级能源 B.石油是二级能源
C.焦炉煤气是一级能源 D.煤是一级能源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
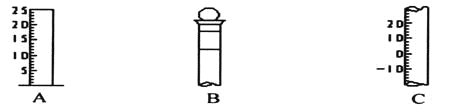
(1)请写出下列仪器的名称:A ,B ,C 。
(2)仪器B上标记有 (填序号)。
①质量 ②温度 ③刻度线 ④浓度 ⑤容积
Ⅱ.现用98%的浓H2SO4(密度为1.84g/cm3)来配制480mL0.2mol/L的稀H2SO4。
有关操作为:①计算所需浓硫酸的体积 ②量取一定体积的浓硫酸 ③稀释、冷却 ④转移、洗涤 ⑤定容 ⑥摇匀。回答下列问题
(3)应用量筒量取的浓硫酸体积是 mL,实验中所用的玻璃仪器除烧杯、玻璃棒、量筒、胶头滴管外还有 。
(4)第③步中稀释浓硫酸的操作是 。
(5)将所配制的稀H2SO4进行测定,发现实际浓度大于0.2mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母) 。
A.用量筒量取浓硫酸时,仰视量筒的刻度 |
B.容量瓶未干燥即用来配制溶液 |
C.浓硫酸在烧杯中稀释后,未冷却就立即转移到容量瓶中,并进行定容 |
D.往容量瓶转移时,有少量液体溅出 |
E.烧杯未进行洗涤
F.在容量瓶中定容时俯视容量瓶刻度线
G.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在溶液中可发生以下反应:
①H++Z-+XO42-→X2++Z2+H2O(未配平),②2M2++R2=2M3++2R-
③2![]() +Z2=R2+2
+Z2=R2+2![]() 。由此判断下列说法正确的是
。由此判断下列说法正确的是
A.氧化性强弱顺序为XO42->Z2>R2>M3+
B.Z2在③中发生氧化反应
C.R元素在反应②中被氧化,在③中被还原
D.常温下反应不可进行2M2++Z2=2M3++2Z-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n (NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=_____________。
已知:K(300℃)>K(350℃),该反应是________热反应。
(2)下图中表示NO2的变化的曲线是____________。
用O2表示从0~2s内该反应的平均速率v=___________。
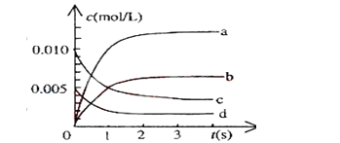
(3)能说明该反应已经达到平衡状态的是___________。
a、v(NO2)=2v(O2) b、容器内压强保持不变
c、v逆(NO)=2v正(O2) d、容器内的密度保持不变
(4)为使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a、及时分离出NO2气体 b、适当升高温度
c、增大O2的浓度 d、选择高效的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com