
下列各组物质中,按单质、化合物、混合物顺序排列的是( )。
A.铁、四氧化三铁、冰水混合物 B.金属钙、生石灰、碱石灰
C.水银、空气、干冰 D.二氧化硫、水蒸气、天然气
科目:高中化学 来源: 题型:
工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置(略去部分夹持仪器)模拟生产过程。
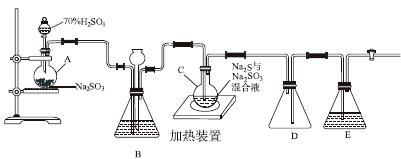
烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)===Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)===3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)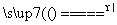 Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
(1)仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液柱,若________________,则整个装置气密性良好。装置D的作用是__________。装置E中为________溶液。
(2)为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为________。
(3)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择________。
a.蒸馏水 b.饱和Na2SO3溶液
c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是__________________________。已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是__________________。反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有________。
a.烧杯 b.蒸发皿
c.试管 d.锥形瓶
(4)反应终止后,烧瓶C中的溶液经蒸发浓缩、冷却结晶即可析出Na2S2O3·5H2O,其中可能含有Na2SO3、Na2SO4等杂质。利用所给试剂设计实验,检测产品中是否存在Na2SO4,简要说明实验操作、现象和结论:________________________________________。
已知Na2S2O3·5H2O遇酸易分解:S2O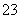 +2H+===S↓+SO2↑+H2O
+2H+===S↓+SO2↑+H2O
供选择的试剂:稀盐酸、稀硫酸、稀硝酸、BaCl2溶液、AgNO3溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
用惰性电极电解一定量的硫酸铜溶液,实验装置如图1所示。电解过程中的实验数据如图2所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标况)。则下列说法中正确的是
A.电解过程中,b电极表面先有红色物质析出,然后才有气泡产生
B.从开始到Q点时收集到的混合气体的平均相对分子质量为17
C.曲线OP 段表示H2和O2混合气体的体积变化,曲线PQ段表示O2的体积变化
D.a电极上发生反应的方程式为:2H+ + 2e- = H2↑和4OH-–4 e-=2H2O+ O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z三种气体,把a mol X与b mol Y充入一密闭容器中,发生反应:
X+2Y 2Z。达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转
2Z。达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转
化率为 
A.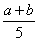 ×100% B.
×100% B.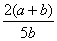 ×100%
×100%
C. ×100% D.
×100% D.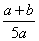 ×100%
×100%
查看答案和解析>>
科目:高中化学 来源: 题型:
在体积为1 L的密闭容器中,进行如下化学反应:
CO2(g)+H2(g)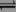 CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表:
CO(g)+H2O(g),化学平衡常数K与温度T的关系如下表:
| T/℃ | 700 | 800 | 850 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的平衡常数表达式K=__________,升高温度,化学平衡向__________
(填“正反应”或“逆反应”)方向移动。
(2)能判断该反应达到化学平衡状态的依据是________。
A.c(CO2)=c(CO) B.K不变 C.容器中的压强不变
D.v正(H2)=v正(CO2) E.c(H2)保持不变
(3)若某温度下,平衡浓度符合下列关系:c(CO2)·c(H2)=c(CO)·c(H2O),此时的温
度为_____;在此温度下,若向该容器中投入1 mol CO2、1.2 mol H2、0.75 mol
CO、1.5 mol H2O,则此时反应朝______方向进行(填“正反应”、“逆反应”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是(NA表示阿伏加德罗常数的值)( )。
A.摩尔是七个基本物理量之一
B.阿伏加德罗常数就是6.02×1023 mol-1
C.1mol氢的质量是2 g
D.1mol甲烷的质量与NA个甲烷分子的质量之和相等
查看答案和解析>>
科目:高中化学 来源: 题型:
要证明CuSO4溶液显蓝色不是由于SO42-离子造成的,下列实验无意义的是( )。
A.观察K2SO4溶液的颜色
B.向CuSO4溶液中滴加适量的NaOH溶液,振荡后静置,溶液颜色消失
C.向CuSO4溶液中滴加适量的Ba(NO3)2溶液,振荡后静置,溶液颜色未消失
D.加水稀释后CuSO4溶液颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学为了验证海带中含有碘,拟进行如下实验,请回答相关问题。
⑴ 第1步:灼烧。操作是将足量海带灼烧成灰烬,该过程中将使用到的硅酸盐质实验仪器有_________________(填代号,限填3项)
A.试管 B.瓷坩埚 C.坩埚钳 D.铁三角架
E.泥三角 F.酒精灯 G.烧杯 H.量筒
⑵ 第2步:I— 溶液的获取。操作是____________________________________________。
⑶ 第3步:氧化。 操作是依次加入合适的试剂,下列氧化剂最好选用_________(填代号),
A.浓硫酸 B.新制氯水 C.KMnO4溶液 D.H2O2
理由是____________________________________________________________。
⑷ 第4步:碘单质的检验。 操作是取少量第3步的溶液,滴加淀粉溶液,如果溶液显蓝色,则证明海带中含碘。
查看答案和解析>>
科目:高中化学 来源: 题型:
利用废旧镀锌铁皮可制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程如下:

已知:Zn及其化合物的性质与Al及其化合物的性质相似。请回答下列问题:
(1)用NaOH溶液处理废旧镀锌铁皮的作用有 。
A.去除油污 B.溶解镀锌层 C.去除铁锈 D.钝化
(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是 。
(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,其原因是 。
(4)Fe3O4胶体粒子能否用减压过滤法实现固液分离? (填“能”或“不能”),理由是 。
(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000mol·L-1的K2Cr2O7标准溶液250mL,应准确称取K2Cr2O7 g(保留4位有效数字,已知MK2Cr2O7=294.0g·mol-1)。配制该标准溶液时,下列仪器不必要用到的有 。(用编号表示)
①电子天平 ②烧杯 ③量筒 ④玻璃棒 ⑤容量瓶 ⑥胶头滴管 ⑦移液管
(6)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则滴定结果将 (填“偏大”、“偏小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com