
| A、Q1+Q2<Q3 |
| B、Q1+Q2>2Q3 |
| C、2Q1+Q2>2Q3 |
| D、2Q1+Q2<2Q3 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
 如图是某学校实验室从化学试剂商店买的98%硫酸试剂标签上的部分内容.据此下列说法正确的是( )
如图是某学校实验室从化学试剂商店买的98%硫酸试剂标签上的部分内容.据此下列说法正确的是( )| A、该硫酸的物质的量浓度为1.84mol/L |
| B、1mol Zn与足量的该硫酸反应产生2gH2 |
| C、配制200mL 4.6mol/L的稀硫酸需取该硫酸50mL |
| D、该硫酸与等体积的水混合所得溶液的物质的量浓度等于9.2mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀硝酸和过量的铁屑反应:3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O | ||||
B、NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-
| ||||
| C、向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O | ||||
| D、KI溶液与H2SO4酸化的H2O2溶液混合:2I-+H2O2+2H+=2H2O+I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质溶液的导电性不一定比弱电解质溶液的导电性强 |
| B、常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4 |
| C、若测得雨水的pH小于7,则下的是酸雨 |
| D、在通风橱中进行有毒气体实验符合“绿色化学”思想 |
查看答案和解析>>
科目:高中化学 来源: 题型:
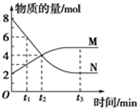 一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.
一定温度下,在2L的恒容密闭容器内发生的反应中M、N的物质的量随反应时间变化的曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、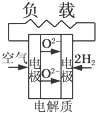 固体氧化物燃料电池 |
B、 碱性氢氧燃料电池 |
C、 质子交换膜燃料电池 |
D、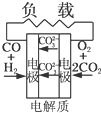 熔融盐燃料电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
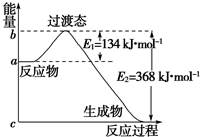 参考下列图表和有关要求回答问题:
参考下列图表和有关要求回答问题:| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com