
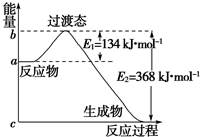
 参考下列图表和有关要求回答问题:
参考下列图表和有关要求回答问题:| 1 |
| 2 |
| 1 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、Q1+Q2<Q3 |
| B、Q1+Q2>2Q3 |
| C、2Q1+Q2>2Q3 |
| D、2Q1+Q2<2Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标况下,22.4L苯的分子数为NA |
| B、10.0mL 18mol/L的浓硫酸中氢离子数为0.36NA |
| C、6.4gS6与S8的混合物中所含S原子数一定为0.2NA |
| D、标准状况下,22.4L氯气与足量氢氧化钠溶液反应转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的 |
| B、在盐酸中加入相同浓度的氨水,若混合液温度下降,说明盐类水解是吸热的 |
| C、在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的 |
| D、在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某温度时,化学反应速率无论用A、B、C何种物质表示,其数值是相同的 |
| B、其他条件不变,增大压强,反应速率加快 |
| C、若增加或减小B的物质的量,则反应速率一定会发生明显的变化 |
| D、其他条件不变,升高温度,反应速率加快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室欲配制0.05mol?L-1的NaOH溶液500mL,有以下仪器:
实验室欲配制0.05mol?L-1的NaOH溶液500mL,有以下仪器:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用AgNO3鉴别工业盐(亚硝酸钠)和食盐二种溶液 |
| B、海带中碘元素提取时氧化滤液中的I-时应加入过量氯水 |
| C、将3-4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
| D、溶质的溶解度越大,溶液的浓度越高,溶剂的蒸发速度越快,溶液的冷却速度越快,析出的晶体就越细小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
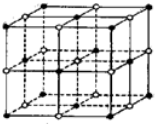
| A、1:8 | B、1:4 |
| C、1:2 | D、1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com