
| A、用AgNO3鉴别工业盐(亚硝酸钠)和食盐二种溶液 |
| B、海带中碘元素提取时氧化滤液中的I-时应加入过量氯水 |
| C、将3-4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
| D、溶质的溶解度越大,溶液的浓度越高,溶剂的蒸发速度越快,溶液的冷却速度越快,析出的晶体就越细小 |


 阶梯计算系列答案
阶梯计算系列答案科目:高中化学 来源: 题型:
A、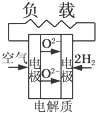 固体氧化物燃料电池 |
B、 碱性氢氧燃料电池 |
C、 质子交换膜燃料电池 |
D、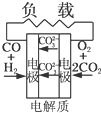 熔融盐燃料电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:
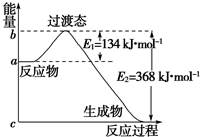 参考下列图表和有关要求回答问题:
参考下列图表和有关要求回答问题:| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、配制FeCl3溶液时,应将FeCl3溶解在适量的盐酸中 |
| B、进行焰色反应时,所用铂丝先用NaOH溶液洗涤并充分灼烧 |
| C、用CCl4萃取碘水中的I2时,有机层从分液漏斗的下端放出 |
| D、酸碱中和滴定时,锥形瓶需用待测液润洗2遍,再加入待测液 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、实验Ⅰ:观察到量筒内黄绿色逐渐消失,量筒内壁有油状物质生成.该现象是由于甲烷与氯气在光照条件下发生了置换反应 |
| B、实验Ⅱ:可以比较KMnO4、Cl2和S氧化性的相对强弱 |
| C、实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D、实验Ⅳ:继续煮沸溶液至红褐色沉淀,停止加热,当光束通过体系时一定可产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去Fe2(SO4)3溶液中混有的Fe SO4:加入足量新制氯水 |
| B、除去FeCl2溶液中混有的FeCl3:加入足量铁粉,过滤 |
| C、铝粉中的镁粉,加入足量氢氧化钠溶液,过滤 |
| D、除去Cu粉中混有的CuO:加适量稀硝酸后,过滤、洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 芒硝化学式为Na2SO4?10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.
芒硝化学式为Na2SO4?10H2O,无色晶体,易溶于水,是一种分布很广泛的硫酸盐矿物.该小组同学设想,如果模拟工业上离子交换膜法制烧碱的方法,用如图所示装置电解硫酸钠溶液来制取氢气、氧气、硫酸和氢氧化钠,无论从节省能源还是从提高原料的利用率而言都更加符合绿色化学理念.查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com