
- 3 |


 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
| A、用AgNO3鉴别工业盐(亚硝酸钠)和食盐二种溶液 |
| B、海带中碘元素提取时氧化滤液中的I-时应加入过量氯水 |
| C、将3-4个火柴头浸于水中,片刻后取少量溶液于试管中,加AgNO3溶液、稀硝酸和NaNO2溶液,若出现白色沉淀,说明含有氯元素 |
| D、溶质的溶解度越大,溶液的浓度越高,溶剂的蒸发速度越快,溶液的冷却速度越快,析出的晶体就越细小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
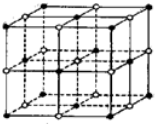
| A、1:8 | B、1:4 |
| C、1:2 | D、1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、自来水 |
| B、0.5mol?L-1醋酸 |
| C、0.5mol?L-1硝酸 |
| D、0.5mol?L-1氨水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一定被氧化了 |
| B、一定被还原了 |
| C、既可能被氧化也可能被还原 |
| D、既不可能被氧化,也不可能被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
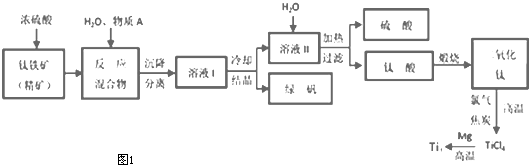
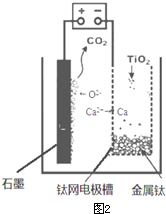
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在含有大量[Al(OH)4]-的溶液中:NH4+、Na+、Cl-、H+ |
| B、在c(H+)=0.1mol?L-1的溶液中:K+、I-、Cl-、NO3- |
| C、在pH=12的溶液中:NH4+、Na+、SO42-、Cl- |
| D、在强碱溶液中:Na+、K+、CO32-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com