
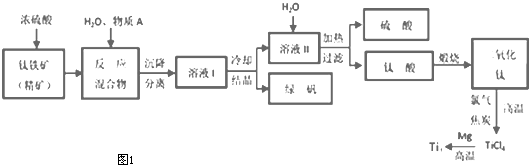
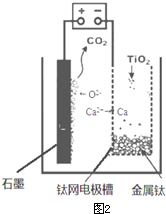
| ||
| ||
| ||
| ||


科目:高中化学 来源: 题型:

| A、实验Ⅰ:观察到量筒内黄绿色逐渐消失,量筒内壁有油状物质生成.该现象是由于甲烷与氯气在光照条件下发生了置换反应 |
| B、实验Ⅱ:可以比较KMnO4、Cl2和S氧化性的相对强弱 |
| C、实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 |
| D、实验Ⅳ:继续煮沸溶液至红褐色沉淀,停止加热,当光束通过体系时一定可产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、检验溶液中是否有SO42-可依次加入的试剂是BaCl2溶液和稀盐酸 |
| B、在pH=2的溶液中可能大量含有:Na+、AlO2-、CO32-、SO32- |
| C、在常温下加入铝粉有氢气放出,则溶液中可能大量含有:K+、Na+、OH-、NO3- |
| D、使紫色石蕊试液变蓝色的溶液中可能大量含有:K+、Na+、Ca2+、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| p1 |
| p2 |
| A、2:5 | B、5:2 |
| C、7:6 | D、6:7 |
查看答案和解析>>
科目:高中化学 来源: 题型:
- 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 高温 |
| A、反应(1)和(2)均为氧化还原反应 |
| B、反应(1)的氧化剂是O2,氧化产物是Na2CrO4和Fe2O3 |
| C、高温下O2的氧化性强于Fe2O3,弱于Na2CrO4 |
| D、反应(1)中每生成2molFe2O3时电子转移4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+ |
| B、OH- |
| C、S2- |
| D、C1- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、水在常温下属于分子晶体 |
| B、水的电离和电解都需要通电 |
| C、水分子很稳定是因为H-O共价键键能大 |
| D、金属的电化学腐蚀与水无关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com