
| 物质 | X | Y | Z | Q |
| 时间 | ||||
| 起始/mol | 0.7 | 1 | ||
| 2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
| 3min末/mol | 0.8 |
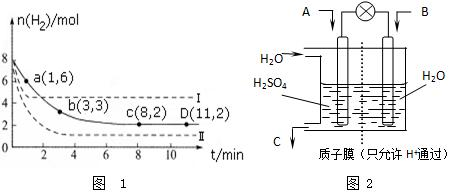
分析 (1)2min内Z的反应速率v(Z)=$\frac{\frac{△n}{V}}{△t}$;
(2)根据Z的反应速率计算Y的反应速率,根据△n=v△tV计算Y、Q参加反应的物质的量,从而确定反应开始n(Y)、n(Q);
(3)计算X的平均反应速率,同一可逆反应同一时间段内各物质的反应速率之比等于其计量数之比;
(4)增大反应物浓度、升高温度、增大压强、加入催化剂等方法都能正反应速率.
解答 解:(1)2min内Z的反应速率v(Z)=$\frac{\frac{△n}{V}}{△t}$=$\frac{\frac{1-0.8}{2}}{2}$mol•L-1•min-1=0.05 mol•L-1•min-1,
故答案为:0.05 mol•L-1•min-1;
(2)v(Z):v(Y)=1:2,则v(Y)=2v(Z)=2×0.05 mol•L-1•min-1=0.1 mol•L-1•min-1,
参加反应的△n(Y)=v(Y)△tV=0.1mol/(L.min)×2L×2min=0.4mol,则反应初始n(Y)=2.7mol-0.4mol=2.3mol
2min内v(Q)=0.075mol•L-1•min-1,参加反应的△n(Q)=v(Q)△tV=0.075mol/(L.min)×2L×2min=0.3mol,则反应初始n(Q)=2.7mol+0.3mol=3mol;
故答案为:2.3 mol;3 mol;
(3)v(X)=$\frac{\frac{0.8-0.7}{2}}{2}$mol/(L.min)=0.025mol/(L.min),同一可逆反应中同一段时间内各物质的反应速率之比等于其计量数之比,所以m:n:p:q=0.025mol/(L.min):0.1 mol•L-1•min-1:0.05 mol•L-1•min-1:0.075mol•L-1•min-1=1:4:2:3,
故答案为:1;4;2;3;
(4)增大反应物浓度、升高温度、增大压强、加入催化剂等方法都能正反应速率,所以符合条件的只有CD,故答案为:C D.
点评 本题考查化学平衡计算及外界条件对化学反应速率影响,为高频考点,侧重考查学生分析判断及计算能力,熟练掌握化学反应速率计算有关公式,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③⑤ | C. | ④⑤ | D. | ④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 容量 | 甲 | 乙 | 丙 | 丁 |
| A | 2mol | 1mol | 2mol | 1mol |
| B | 1mol | 1mol | 2mol | 2mol |
| A. | A的转化率:丁>丙>乙>甲 | B. | A的转化率:丁>乙>丙>甲 | ||
| C. | B的转化率:丙>甲>乙>丁 | D. | B的转化率:甲>乙>丙>丁 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 甲 | 乙 | 丙 | 丁 | ||
| 密闭容器体积/L | 2 | 2 | 2 | 1 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0.80 | 0.80 | 0.40 |
| n(O2)/mol | 0.24 | 0.24 | 0.48 | 0.24 | |
| SO2的平衡转化率% | 80 | α1 | α2 | α3 | |
| A. | 甲中反应的平衡常数小于乙 | |
| B. | 该温度下,该反应的平衡常数K为400 | |
| C. | SO2的平衡转化率:α1>α2=α3 | |
| D. | 容器中SO3的物质的量浓度:丙=丁<甲 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
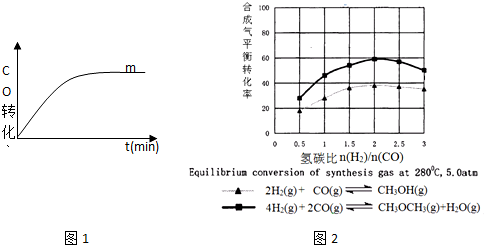
| 序号 | 温度(°C) | 起始浓度(mol•L-1) | 平衡浓度(mol•L-1) | ||||
| CO | H2 | CH3OH | CO | H2 | CH3OH | ||
| ① | T | 1 | 3 | 0 | 0.2 | 1.4 | 0.8 |
| ② | T | 1.5 | 4.6 | 0.1 | b1 | b2 | b3 |
| ③ | T+30 | 1 | 3 | 0 | 0.25 | 1.5 | 0.75 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
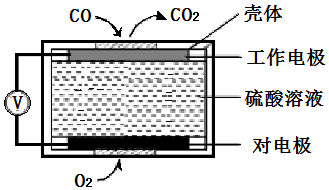
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
| 锥形瓶中溶液 | 滴定管中溶液 | 选用指示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
| 醋酸浓度(mol•L-1) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com