
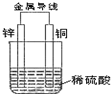
| A. | 铜片上有气泡产生 | B. | 铜片质量逐渐减少 | ||
| C. | 电子从锌片经导线流向铜 | D. | 该装置把化学能转化为电能 |
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ||||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ||||
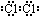 ,由②、④两种元素的原子按1:1组成化合物的电子式为
,由②、④两种元素的原子按1:1组成化合物的电子式为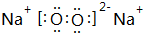 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol•L-1MgCl2溶液中含有的Mg2+数目一定小于0.1NA | |
| B. | 标准状况下,11.2 L CCl4中含有的分子数目为0.5NA | |
| C. | 4.6g由NO2和N2O4组成的混合物中含有氧原子的数目为0.2 NA | |
| D. | 1 mol CH5+中含有的电子数目为11NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(l)△H=-1135.7 kJ•mol-1 | |
| B. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1000.3 kJ•mol-1 | |
| C. | N2H4(g)+NO2(g)═$\frac{3}{2}$N2(g)+2H2O(l)△H=-1135.7 kJ•mol-1 | |
| D. | 2N2H4(g)+2NO2(g)═3N2(g)+4H2O(g)△H=-1135.7 kJ•mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 34S原子核内的中子数为16 | B. | 16O与18O互称同位素 | ||
| C. | 13C和15N原子核内的质子数相差2 | D. | 2H的核外电子数比1H多一个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ Na+ SO42- OH- | B. | Ca2+K+ HCO3-OH- | ||
| C. | Na+ H+ CH3COO- SO42- | D. | Ba2+ K+NO3-Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16gO2所含的原子数NA | |
| B. | 标准状况下,2.24L水所含的电子数为10NA | |
| C. | 2.4g金属镁与足量盐酸反应失去电子数0.2NA | |
| D. | 1.6g甲烷含有共用电子对数目0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用无水酒精萃取碘水中的碘 | |
| B. | Na2O2粉末加人到FeSO4溶液中.产生白色沉淀,并放出大量气泡 | |
| C. | 将浓氨水滴加到碱石灰中可制得氨气,也可用碱石灰干燥氨气 | |
| D. | 往酸性KMnO4溶液中通人SO2验证SO2的漂白性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com