
|
在密闭容器中充入1 mol CO,2 mol H2O,一定条件下发生可逆反应CO(g)+H2O(g) | |
| [ ] | |
A. |
40% |
B. |
50% |
C. |
75% |
D. |
80% |
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:
合成氨对工、农业生产和国防都有重要意义。
已知:N2(g)+3H2(g)![]() 2NH3(g);ΔH=-92.4 kJ·mol-1。请回答:
2NH3(g);ΔH=-92.4 kJ·mol-1。请回答:
(1)合成氨工业中采取的下列措施可以用勒夏特列原理解释的是 (填字母)。
a.用铁触媒加快化学反应速率 b.采用较高压强(20MPa~50MPa)
c.将原料气中的少量CO等气体净化除去d.将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1 mol N2和3 mol H2并发生反应。若容器容积恒定,达到平衡时,气体的压强为原来的![]() ,则N2的转化率a1= ,此时,反应放热 kJ;
,则N2的转化率a1= ,此时,反应放热 kJ;
查看答案和解析>>
科目:高中化学 来源: 题型:
(14分)合成氨对工、农业生产和国防都有重要意义。
已知:N2(g)+3H2(g)![]() 2NH3(g);△H=-92.4 kJ·mol-1,请回答:
2NH3(g);△H=-92.4 kJ·mol-1,请回答:
(1)合成氨工业中采取的下列措施可以用勒夏特列原理解释的是_____(填字母)。
a.用铁触媒(催化剂)加快化学反应速率
b.采用较高压强(20 MPa~50 MPa)
c.将原料气中的少量CO等气体净化除去
d.将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1 mol N2和3 mol H2并发生反应。
①若容器容积V恒定,达到平衡时,气体的压强为原来的![]() ,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
②若容器压强恒定,则达到平衡时,容器中N2的转化率а2__а1(填“>、<或=”)。
(3)随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)。钯电极A是电解池的____极(填“阳”或 “阴”),该极上的电极反应式是 。
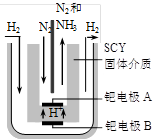
查看答案和解析>>
科目:高中化学 来源:2010年陕西省五校高三第一次模拟考试理综化学试题 题型:填空题
(14分)合成氨对工、农业生产和国防都有重要意义。
已知:N2(g)+3H2(g)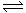 2NH3(g);△H= -92.4 kJ·mol-1,请回答:
2NH3(g);△H= -92.4 kJ·mol-1,请回答:
(1)合成氨工业中采取的下列措施可以用勒夏特列原理解释的是_____(填字母)。
a.用铁触媒(催化剂)加快化学反应速率
b.采用较高压强(20 MPa~50 MPa)
c.将原料气中的少量CO等气体净化除去
d.将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1 mol N2和3 mol H2并发生反应。
①若容器容积V恒定,达到平衡时,气体的压强为原来的 ,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
②若容器压强恒定,则达到平衡时,容器中N2的转化率а2__а1(填“>、<或=”)。
(3)随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)。钯电极A是电解池的____极(填“阳”或 “阴”),该极上的电极反应式是 。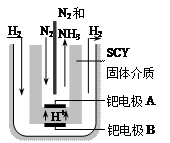
查看答案和解析>>
科目:高中化学 来源:2013-2014学年广东省、广雅高三四校联考理综化学试卷(解析版) 题型:填空题
煤制备CH4是一种有发展前景的新技术。
I. 煤炭气化并制备CH4包括以下反应:
C(s)+H2O(g)=CO(g)+H2 (g) ? ΔH 1 = +131 kJ/mol
CO(g) + H2O(g)=CO2 (g)+ H2(g) ? ΔH 2 = ?41 kJ/mol
CO(g) + 3H2 (g)=CH4 (g)+ H2O(g) ? ΔH 3 = ?206 kJ/mol
(1)写出煤和气态水制备CH4(产物还有CO2)的热化学方程式??????????????????????????????????? 。
(2)煤转化为水煤气(CO和H2)作为燃料和煤直接作为燃料相比,主要的优点有???????????????????? 。
(3)写出甲烷—空气燃料电池(电解质溶液为KOH溶液)中负极的电极反应式?????????????????????? 。
II. 对以上反应CO(g) + H2O(g)  CO2 (g)+ H2(g) ΔH 2 = ?41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
CO2 (g)+ H2(g) ΔH 2 = ?41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
实验编号 | 容器体积/L | 温度/°C |
① | 2.0 | 1200 |
② | 2.0 | 1300 |
③ | 1.0 | 1200 |
(1)实验①中c(CO2)随时间变化的关系见下图,请在答题卡的框图中,画出实验②和③中c(CO2)随时间变化关系的预期结果示意图。

(2)在与实验①相同的条件下,起始时充入容器的物质的量:n(CO)=n(H2O)=n(CO2) =n( H2)=1.00mol。通过计算,判断出反应进行的方向。(写出计算过程。)
查看答案和解析>>
科目:高中化学 来源:2010年陕西省五校高三第一次模拟考试理综化学试题 题型:综合题
(14分)合成氨对工、农业生产和国防都有重要意义。
已知:N2(g)+3H2(g) 2NH3(g);△H=
-92.4 kJ·mol-1,请回答:
2NH3(g);△H=
-92.4 kJ·mol-1,请回答:
(1)合成氨工业中采取的下列措施可以用勒夏特列原理解释的是_____(填字母)。
a.用铁触媒(催化剂)加快化学反应速率
b.采用较高压强(20 MPa~50 MPa)
c.将原料气中的少量CO等气体净化除去
d.将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1 mol N2和3 mol H2并发生反应。
①若容器容积V恒定,达到平衡时,气体的压强为原来的 ,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
,则N2的转化率а1=_____,此时,反应放热_____kJ;该温度下合成氨反应的平衡常数K=_____(只需列出数字表达式);
②若容器压强恒定,则达到平衡时,容器中N2的转化率а2__а1(填“>、<或=”)。
(3)随着对合成氨研究的发展,希腊科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现了常压、570℃条件下高转化率的电解法合成氨(装置如下图)。钯电极A是电解池的____极(填“阳”或 “阴”),该极上的电极反应式是 。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com