
煤制备CH4是一种有发展前景的新技术。
I. 煤炭气化并制备CH4包括以下反应:
C(s)+H2O(g)=CO(g)+H2 (g) ? ΔH 1 = +131 kJ/mol
CO(g) + H2O(g)=CO2 (g)+ H2(g) ? ΔH 2 = ?41 kJ/mol
CO(g) + 3H2 (g)=CH4 (g)+ H2O(g) ? ΔH 3 = ?206 kJ/mol
(1)写出煤和气态水制备CH4(产物还有CO2)的热化学方程式??????????????????????????????????? 。
(2)煤转化为水煤气(CO和H2)作为燃料和煤直接作为燃料相比,主要的优点有???????????????????? 。
(3)写出甲烷—空气燃料电池(电解质溶液为KOH溶液)中负极的电极反应式?????????????????????? 。
II. 对以上反应CO(g) + H2O(g)  CO2 (g)+ H2(g) ΔH 2 = ?41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
CO2 (g)+ H2(g) ΔH 2 = ?41 kJ/mol,起始时在密闭容器中充入1.00 molCO和1.00 molH2O,分别进行以下实验,探究影响平衡的因素(其它条件相同且不考虑任何副反应的影响)。实验条件如下表:
实验编号 | 容器体积/L | 温度/°C |
① | 2.0 | 1200 |
② | 2.0 | 1300 |
③ | 1.0 | 1200 |
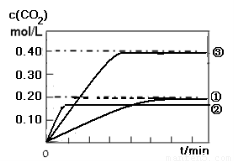
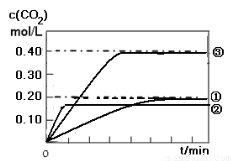
(1)实验①中c(CO2)随时间变化的关系见下图,请在答题卡的框图中,画出实验②和③中c(CO2)随时间变化关系的预期结果示意图。

(2)在与实验①相同的条件下,起始时充入容器的物质的量:n(CO)=n(H2O)=n(CO2) =n( H2)=1.00mol。通过计算,判断出反应进行的方向。(写出计算过程。)
I.(1)2C(s)+ 2H2O(g)= CH4 (g)+ CO2 (g)? ΔH = +15 kJ/mol ???? (3分 )
(2)提高煤的利用率(节约能源或节约资源)(1分)、减少污染。(1分)
(3)CH4—8e-+10OH-=CO32-+7H2O(2分)
II. (1) 如图所示
(2)Q> K?? 反应向逆反应方向(生成CO和H2O的方向)进行? ? (1分)
【解析】
试题分析: I. (1) 根据盖斯定律和已知方程式,煤和气态水制备甲烷的热化学方程式可由方程式①×2+②+③而得,所以ΔH=2ΔH 1+ ΔH 2+ΔH 3 = +15 kJ/mol ,所以热化学方程式为:2C(s)+ 2H2O(g)= CH4 (g)+ CO2 (g)? ΔH = +15 kJ/mol 。
(2) 煤气化后生成水煤气再燃烧比直接燃烧煤更加充分,提高能源利用率,同时燃煤容易产生酸雨,所以燃烧水煤气还可以减少污染。
(3)用甲烷作燃料制成的碱性燃料电池中,甲烷失电子生成的CO2气体会与溶液中的碱性介质进一步反应生成CO32-,所以其负极的反应式为:CH4—8e-+10OH-=CO32-+7H2O。
II. (1) CO(g) + H2O(g)  CO2 (g)+ H2(g) 的反应是一个放热反应,所以温度升高,反应的反应速率加快,但使平衡逆向移动,实验②曲线比实验①曲线更快达到平衡,但是平衡时CO2的浓度要低一些;相比之下,实验③比试验①缩小了体积,即增大了压强,由于反应前后气体系数不变,所以增大压强只能增大化学反应速率,但是不能改变平衡,因此实验③的曲线比实验①更快达到平衡,且平衡时CO2的浓度是实验①的2倍。如图
CO2 (g)+ H2(g) 的反应是一个放热反应,所以温度升高,反应的反应速率加快,但使平衡逆向移动,实验②曲线比实验①曲线更快达到平衡,但是平衡时CO2的浓度要低一些;相比之下,实验③比试验①缩小了体积,即增大了压强,由于反应前后气体系数不变,所以增大压强只能增大化学反应速率,但是不能改变平衡,因此实验③的曲线比实验①更快达到平衡,且平衡时CO2的浓度是实验①的2倍。如图
(2)整体思路:先根据实验①充入的物质的物质的量和平衡时候CO2的浓度计算出在相同温度下的平衡常数K,然后比较此时的浓度商Q与实验①的K值的大小,从而得出反应进行的方向。
计算过程为:
(2) 平衡时n(CO2)=0.20mol/Lx2.0L=0.40mol
CO(g) + H2O(g)  CO2 (g)+ H2(g)
CO2 (g)+ H2(g)
起始物质的量/mol? 1.00? 1.00? 1.00??? 1.00
变化物质的量/mol? 0.40? 0.40? 0.40??? 0.40
平衡物质的量/mol? 0.60? 0.60? 0.40??? 0.40 (1分)
K=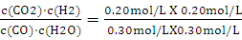 =0.44 (2分)
=0.44 (2分)
Q=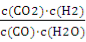 =
=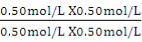 = 1.0 (1分)
= 1.0 (1分)
Q> K???? 反应向逆反应方向(生成CO和H2O的方向)进行? ? (1分)
考点:本题考查的是化学反应原理知识,主要包括盖斯定律应用、热化学方程式的书写、影响化学平衡的因素、图像问题、反应方向的判断计算。


科目:高中化学 来源: 题型:阅读理解
(1)C1化学是指从一个碳原子的化合物(如CH4,CO,CO2,CH3OH,HCHO等)出发合成各种化学品的技术。从煤、天然气制合成气再进一步制备各种化工产品和洁净燃料,已成为当今化学工业发展的必然趋势。其中甲醇是C1化学的基础。
①CO与H2按一定比例可生成乙二醇,则n(CO)/n(H2)=_____________(填数字)。
②若汽油平均组成用CmHn表示,则合成汽油控制n(CO)/n(H2)=(用m、n表示)。
③甲醇在一定条件下与CO、H2作用生成有机物A,A发生加聚可生成高分子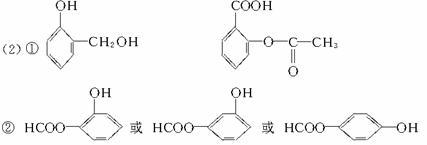 写出生成A的化学方程式:_________________________________。
写出生成A的化学方程式:_________________________________。
(2)已知醇醛在一定条件下能发生缩合反应,示例如下:
已知:
①1827年人们就发现有机物A,它的分子式为C13H18O7,与一分子水作用,水解生成B和C。
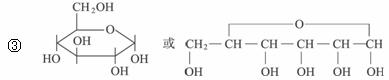
②B能发生银镜反应,B也可由淀粉水解得到,B的分子式为C6H12O6。
③C遇氯化铁溶液能发生显色反应,1 mol C与足量钠反应可产生1 mol H2。
④C在适当的条件下用适当氧化剂氧化,可得D,D的分子式为C7H6O3,相对分子质量D比C大14。
⑤D有两个取代基,但不是间位,它与Br2在催化剂作用下发生一溴取代,产物有四种,D能与碳酸氢钠溶液反应。
⑥D与乙酸酐〔(CH3CO)2O〕反应,可得常见药物E和乙酸,E能与碳酸氢钠反应放出二氧化碳。
试回答下列问题:
①写出结构简式:C_________________,E_________________。
②写出与D互为同分异构体,含有苯环且含有酯结构的结构简式:_________________(只需写一种)。
③B通常以六元环状结构存在,写出B的环状结构简式:_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com