
(1)C1化学是指从一个碳原子的化合物(如CH4,CO,CO2,CH3OH,HCHO等)出发合成各种化学品的技术。从煤、天然气制合成气再进一步制备各种化工产品和洁净燃料,已成为当今化学工业发展的必然趋势。其中甲醇是C1化学的基础。
①CO与H2按一定比例可生成乙二醇,则n(CO)/n(H2)=_____________(填数字)。
②若汽油平均组成用CmHn表示,则合成汽油控制n(CO)/n(H2)=(用m、n表示)。
③甲醇在一定条件下与CO、H2作用生成有机物A,A发生加聚可生成高分子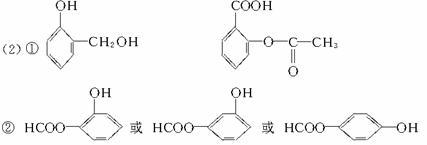 写出生成A的化学方程式:_________________________________。
写出生成A的化学方程式:_________________________________。
(2)已知醇醛在一定条件下能发生缩合反应,示例如下:
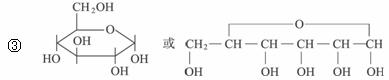
已知:
①1827年人们就发现有机物A,它的分子式为C13H18O7,与一分子水作用,水解生成B和C。
②B能发生银镜反应,B也可由淀粉水解得到,B的分子式为C6H12O6。
③C遇氯化铁溶液能发生显色反应,1 mol C与足量钠反应可产生1 mol H2。
④C在适当的条件下用适当氧化剂氧化,可得D,D的分子式为C7H6O3,相对分子质量D比C大14。
⑤D有两个取代基,但不是间位,它与Br2在催化剂作用下发生一溴取代,产物有四种,D能与碳酸氢钠溶液反应。
⑥D与乙酸酐〔(CH3CO)2O〕反应,可得常见药物E和乙酸,E能与碳酸氢钠反应放出二氧化碳。
试回答下列问题:
①写出结构简式:C_________________,E_________________。
②写出与D互为同分异构体,含有苯环且含有酯结构的结构简式:_________________(只需写一种)。
③B通常以六元环状结构存在,写出B的环状结构简式:_________________________。
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
(a)A、B、C、D、E五种元素的原子序数依次增大,且A、D同主族,C、E同主族,B、C同周期。
(b)W由A、B组成,分子中原子个数比为A∶B=1∶1,常温时为气态。
(c)X由A、C组成,分子中原子个数比为A∶B=2∶1,常温时为液态。
(d)Y是由C、D形成的离子化合物,且Y中相应元素的微粒之比为:C∶D=1∶1。
(e)Z是由D、E形成的离子化合物,其中阳离子比阴离子少一个电子层,阴、阳离子个数比为1∶2。试完成下列各小题:
(1)各元素符号:A_____,B_____,C_____,D_____,E_____。
(2)W的化学式:__________。
(3)X的结构式:__________。
(4)Y的电子式:__________。
(5)Z的化学式:__________。
(6)写出下列反应化学方程式:Y与水反应__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有四种化合物W、X、Y、Z,它们都是由短周期元素A、B、C、D、E中的两种元素组成的。已知:
(a)A、B、C、D、E五种元素的原子序数依次增大,且A、D同主族,C、E同主族,B、C同周期。
(b)W由A、B组成,分子中原子个数比为A∶B=1∶1,常温时为气态。
(c)X由A、C组成,分子中原子个数比为A∶B=2∶1,常温时为液态。
(d)Y是由C、D形成的离子化合物,且Y中相应元素的微粒之比为:C∶D=1∶1。
(e)Z是由D、E形成的离子化合物,其中阳离子比阴离子少一个电子层,阴、阳离子个数比为1∶2。试完成下列各小题:
(1)各元素符号:A_____,B_____,C_____,D_____,E_____。
(2)W的化学式:__________。
(3)X的结构式:__________。
(4)Y的电子式:__________。
(5)Z的化学式:__________。
(6)写出下列反应化学方程式:Y与水反应__________。
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(1)化学实验必须注意安全,下列做法存在安全隐患的是___________(选填字母)。
A.氢气还原氧化铜实验中,先加热氧化铜后通氢气
B.蒸馏石油时,加热一段时间后发现未加碎瓷片,立刻拔开橡皮塞并投入碎瓷片
C.实验室做钠的实验时,余下的钠屑投入到废液缸中
D.配制浓硫酸与酒精混合液时,将1体积的酒精倒入3体积的浓硫酸中
E.皮肤上沾有少量浓硝酸时,立刻用大量水冲洗,再涂上稀碳酸氢钠溶液
F.制乙烯时,用量程为300 ℃的温度计代替量程为200 ℃的温度计,测反应液的温度
(2)间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+与I-作用定量析出I2,I2溶于过量的KI溶液中:
I2+I-====![]() ,又知氧化性:Fe3+>Cu2+>I2>
,又知氧化性:Fe3+>Cu2+>I2>![]() 。
。
析出的I2可用c mol·L-1 Na2S2O3标准溶液滴定:2![]() +
+![]() ====
====![]() +3I-。
+3I-。
准确称取a g胆矾试样,置于250 mL碘量瓶(带磨口塞的锥形瓶)中,加50 mL蒸馏水、5 mL 3 mol·L-1 H2SO4溶液,加少量NaF,再加入足量的10% KI溶液,摇匀。盖上碘量瓶瓶盖,置于暗处5 min,充分反应后,加入1—2 mL 05%的淀粉溶液,用Na2S2O3标准溶液滴定到蓝色褪去时,共用去V mL标准液。
①实验中,在加KI前需加入少量NaF,推测其作用可能是:______________________。
②实验中加入5 mL 3 mol·L-1 H2SO4溶液,你认为硫酸的作用是:_______________________。
③本实验中用碘量瓶而不用普通锥形瓶是因为:_____________________________________。
④硫酸铜溶液与碘化钾溶液反应生成白色沉淀(碘化亚铜)并析出碘,该反应的离子方程式为:____________________________________________________________________。
⑤根据本次实验结果,该胆矾试样中铜元素的质量分数为w(Cu)=______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com