
分析 (1)在常温下,有体积为Va升、pH值为a的稀硫酸和体积为Vb升,pH值为b的烧碱溶液混和,若所得混合液为中性.说明氢离子和氢氧根离子前后反应,得到:
Va×10-a=Vb×$\frac{1{0}^{-14}}{1{0}^{-b}}$,如果a+b=13,计算得到Va:Vb;
根据该温度下水的离子积计算出氢氧化钠的浓度、硫酸中氢离子浓度,然后根据反应后溶液显示中性计算出两溶液的体积之比;
(2)等体积、等pH的Ba(OH)2、NaOH中,c(OH-)相同,但NH3•H2O为弱碱,等pH时,其浓度大于NaOH,然后结合酸碱中和时c(OH-)越大,消耗酸越多;
(3)①同体积,同pH的三种酸中,盐酸和硫酸中氢离子的物质的量相等,醋酸溶液中醋酸的物质的量大于盐酸,酸中氢离子的物质的量与生成二氧化碳的体积成正比;
②反应速率与氢离子浓度成正比;酸中氢离子浓度越大,反应速率越快,反应时间越短,反应过程中醋酸不断电离.
解答 解:(1)体积为Va升、pH值为a的稀硫酸和体积为Vb升,pH值为b的烧碱溶液混和,若所得混合液为中性.说明氢离子和氢氧根离子前后反应,得到:
Va×10-a=Vb×$\frac{1{0}^{-14}}{1{0}^{-b}}$,如果a+b=13,计算得到Va:Vb =10-14+a+b=10-10=1:10;
若所得混合溶液为中性,pH=b的NaOH溶液中c(H+)=10-bmol/L,c(OH-)=$\frac{1×1{0}^{-13}}{1{0}^{-b}}$mol/L
pH=a的硫酸溶液中c(H+)=10-amol/L,因c(H+)×Va=c(OH-)×Vb,则10-a×Va=$\frac{1×1{0}^{-13}}{1{0}^{-b}}$×Vb,则Va:Vb=1:1,
故答案为:1:10;1:1;
(2)等体积、等pH的Ba(OH)2、NaOH中,c(OH-)相同,滴加等浓度的盐酸将它们恰好中和,用去酸的体积V1=V2,
但NH3•H2O为弱碱,等pH时,其浓度大于NaOH,滴加等浓度的盐酸将它们恰好中和,弱碱继续电离产生氢氧根离子,则消耗酸多,即V2<V3,
所以消耗酸的体积关系为:V3>V2=V1,
故答案为:V3>V2=V1;
(3)醋酸和盐酸都是一元酸,醋酸是弱酸,盐酸是强酸,硫酸是二元强酸,所以醋酸中存在电离平衡,氯化氢和硫酸完全电离,
①同体积,同pH的三种酸中,盐酸和硫酸中氢离子的物质的量相等,醋酸溶液中醋酸的物质的量大于盐酸,分别加入足量的碳酸钠粉末,氢离子的物质的量越大,生成的二氧化碳体积越大,硫酸和盐酸中生成的二氧化碳体积相同,醋酸中生成的二氧化碳体积最大,所以在相同条件下产生CO2的体积由大到小的顺序是c>a=b,
故答案为:c>a=b;
②反应速率与氢离子浓度成正比,开始时这三种溶液中氢离子浓度相等,所以开始反应速率相等,随着反应的进行,醋酸不断电离出氢离子,盐酸和硫酸不再电离出氢离子,所以反应过程中氢离子浓度醋酸最大,硫酸和盐酸中相等,所以反应速率醋酸>硫酸=盐酸,则反应时间c<a=b,
故答案为:a=b=c;c<a=b.
点评 本题考查了弱电解质的电离,明确弱电解质电离特点是解本题关键,知道反应过程、稀释构成中醋酸都不断电离出氢离子,反应速率只与氢离子浓度有关,与电解质强弱无关,为易错点,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
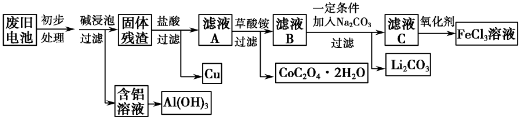
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 反应A2+B2?2AB,△H=QkJ/molB的生成情况如图所示:a为500℃、b为300℃的情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是( )
反应A2+B2?2AB,△H=QkJ/molB的生成情况如图所示:a为500℃、b为300℃的情况,c为反应在300℃时从时间t3开始向容器中加压的情况,则下列叙述正确的是( )| A. | A2、B2及AB均为气体,Q>0 | |
| B. | AB为气体,A2、B2中有一种为非气体,Q>0 | |
| C. | AB为气体,A2、B2中有一种为非气体,Q<0 | |
| D. | AB为固体,A2、B2中有一种为非气体,Q>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自来水 | B. | 0.5 mol•L-1盐酸 | ||
| C. | 0.5 mol•L-1 醋酸 | D. | 0.5 mol•L-1 氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=3的盐酸中:c(H+)=3.0mol•L-1 | |
| B. | NaHS溶液中:c(Na+)=c(HS-)+2c(S2-) | |
| C. | 饱和AgI溶液与饱和AgCl溶液相比,前者c(Ag+)大 | |
| D. | 碳酸氢钠溶液中既存在电离平衡,又存在水解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使紫色石蕊试液变红的溶液中:Fe2+、Na+、SO42-、NO3- | |
| B. | 碱性溶液中:Na+、K+、NO3-、ClO- | |
| C. | pH=1的溶液中:Na+、Cu2+、Cl-、S2- | |
| D. | 加入Al能放出氢气的溶液中:NH4+、SO42-、NO3-、ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
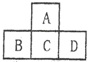 有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素的原子核外共有56个电子,在周期表中的位置如图所示.E元素的最高价氧化物既能与强酸反应又能与强碱反应.请回答:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素的原子核外共有56个电子,在周期表中的位置如图所示.E元素的最高价氧化物既能与强酸反应又能与强碱反应.请回答: ,.
,.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com