

分析 (1)除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,可以加过量的氯化钡除去硫酸根离子,然后用碳酸钠去除钙离子和过量的钡离子.盐酸要放在最后,来除去过量的氢氧化钠和碳酸钠,加氢氧化钠和氯化钡无先后顺序要求;
(2)氯气和氢氧化钙反应生成氯化钙和次氯酸钙,次氯酸酸性比碳酸弱,次氯酸钙与二氧化碳、水反应生成碳酸钙和次氯酸;
(3)溴和二氧化硫发生反应Br2+SO2+2H2O=2HBr+H2SO4,再向含有HBr的溶液中通入适量氯气蒸馏得到溴单质,可起到富集溴元素的目的,反应生成强酸,应注意防护设备被腐蚀;
(4)反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,氧化剂与还原剂物质的量之比为5:1,据此计算;
(5)氯化镁易水解,制备晶体时应防止水解,不锈钢做阴极电解熔融的氯化镁时,阳极发生氧化反应生成氯气.
解答 解:(1)加过量的NaOH溶液是为了除去Mg2+,加过量的BaCl2溶液是为了除去SO42-,加过量Na2CO3溶液是为了除去Ca2+和过量的Ba2+,故Na2CO3溶液的加入一定在NaOH溶液之后,而且要在过滤之后再加盐酸,故正确的操作顺序可以是②⑤④①③;
故答案为:C;
(2)氯气和氢氧化钙反应生成氯化钙和次氯酸钙,方程式为2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O,次氯酸酸性比碳酸弱,次氯酸钙与二氧化碳、水反应生成碳酸钙和次氯酸,方程式为Ca(ClO)2+CO2+H2O=CaCO3+2HClO,
故答案为:2Ca(OH)2+2Cl2=Ca(ClO)2+CaCl2+2H2O;Ca(ClO)2+CO2+H2O=CaCO3+2HClO;
(3)步骤I中已获得Br2,步骤II中又将Br2还原为Br-,步骤I中获取的溴浓度较小,所以其目的是富集溴元素,溴具有强氧化性,二氧化硫具有还原性,二者能发生氧化还原生成硫酸和氢溴酸,离子反应方程式为:Br2+SO2+2H2O=4H++SO42-+2Br-;生成的两种酸都是强酸,对设备腐蚀较严重,所以要解决的主要问题是设备被腐蚀问题,
故答案为:富集溴元素;强酸对设备的腐蚀;
(4)反应中Br2起氧化剂、还原剂作用,根据电子转移守恒可知,2×n氧化剂(Br2)=2×5×n还原剂(Br2),故n氧化剂(Br2):n还原剂(Br2)=5:1,故吸收10mol Br2时,转移的电子数为10mol×2×$\frac{1}{1+5}$×5=$\frac{50}{3}$mol,故答案为:$\frac{50}{3}$;
(5)氯化镁中的镁离子易水解,在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2•6H2O受热产生的水汽,故能得到无水MgCl2,不锈钢做阴极电解熔融的氯化镁时,阳极发生氧化反应生成氯气,方程式为2Cl--2e-=Cl2↑,
故答案为:在干燥的HCl气流中,抑制了MgCl2水解,且带走MgCl2•6H2O受热产生的水汽,故能得到无水MgCl2;2Cl--2e-=Cl2↑.
点评 本题考查物质的分离提纯,为高考常见题型,侧重于学生的分析、实验和计算能力的考查,注意把握实验的原理和操作方法,难度中等.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 原电池的负极、电解池的阳极均发生氧化反应 | |
| B. | 原电池将化学能转化为电能,电解池将电能转化为化学能 | |
| C. | 电解水制取H2和O2时,为了增强导电性,可加入NaOH、NaCl、H2SO4 | |
| D. | 利用原电池原理可制备化学电源,利用电解池原理可制备化学物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 NaCI是一种化工原料,可以制备一系 列物质(如图所示),下列说法正确的是( )
NaCI是一种化工原料,可以制备一系 列物质(如图所示),下列说法正确的是( )| A. | 常温干燥的Cl2能用钢瓶储存,所以Cl2不与铁反应 | |
| B. | 工业上利用澄清石灰水与Cl2反应来制漂白粉 | |
| C. | 往NaCl溶液中先通足量氨气后,再通入足量CO2才可能析出NaHCO3 | |
| D. | 电解含酚酞的NaCl溶液,由于OH-往阳极移动,故阳极先变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锡有SnCl2、SnCl4两种氯化物.SnCl4是无色液体,极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃.实验室用熔融的金属锡跟干燥的氯气直接作用制取无水SnCl4(此反应过程放出大量的热).实验室制取无水SnCl4的装置如图所示.
锡有SnCl2、SnCl4两种氯化物.SnCl4是无色液体,极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃.实验室用熔融的金属锡跟干燥的氯气直接作用制取无水SnCl4(此反应过程放出大量的热).实验室制取无水SnCl4的装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

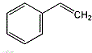 .
. +NaOH $→_{△}^{水}$
+NaOH $→_{△}^{水}$ +NaBr.
+NaBr. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

 HCO3-+OH-,溶液显碱性,促进油脂的水解(结合相关离子方程式解释).
HCO3-+OH-,溶液显碱性,促进油脂的水解(结合相关离子方程式解释).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②④⑥ | C. | ①② | D. | ③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com