
 锡有SnCl2、SnCl4两种氯化物.SnCl4是无色液体,极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃.实验室用熔融的金属锡跟干燥的氯气直接作用制取无水SnCl4(此反应过程放出大量的热).实验室制取无水SnCl4的装置如图所示.
锡有SnCl2、SnCl4两种氯化物.SnCl4是无色液体,极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃.实验室用熔融的金属锡跟干燥的氯气直接作用制取无水SnCl4(此反应过程放出大量的热).实验室制取无水SnCl4的装置如图所示.分析 (1)依据实验室常见仪器回答;
(2)Sn在金属活动性顺序表中排在H的前面,较为活泼,据此解答即可;
(3)由信息可知SnCl4遇水水解,F中氢氧化钠溶液中水蒸气易挥发进入E中;
(4)依据题意:此反应过程放出大量的热,故反应开始后,依靠反应放出的热量即可使Sn熔化;产率=$\frac{实际产量}{理论产量}$×100%,据此解答即可;
(5)四氯化锡遇水强烈水解,生成SnO2、HCl,SnO2是固体颗粒,HCl结合空气中的水蒸气,出现白色烟雾;
(6)由于还原性Sn2+>I-,若产品中混有SnCl2,应能氧化碘离子生成碘单质,据此解答即可.
解答 解:(1)仪器A为蒸馏烧瓶,仪器B为冷凝管,又称为冷凝器,故答案为:蒸馏烧瓶;冷凝管;
(2)Sn在金属活动性顺序表中排在H的前面,Sn可能与HCl反应生成SnCl2,故为了防止此反应的发生,需要除去氯气中的HCl,由于SnCl4极易水解,故此需要干燥的氯气,故答案为:Sn可能与HCl反应生成SnCl2;防止SnCl4水解;
(3)E收集产品,F中氢氧化钠溶液中水蒸气易挥发,进入E中,易使SnCl4水解.在E和F之间增加干燥装置可以避免此种情况发生,故答案为:E、F之间连装有碱石灰的干燥管;
(4)此反应过程放出大量的热,故反应开始后,依靠反应放出的热量即可使Sn熔化,11.9gSn粉的物质的量为:$\frac{11.9g}{119g/mol}$=0.1mol,故应生成SnCl4极的物质的量为0.1mol,即质量为:0.1mol×(119+4×35.5)g/mol=26.1g,产率=$\frac{23.8g}{26.1g}$×100%≈91.2%,故答案为:Sn和Cl2 反应放出大量的热; 0.912;
(5)四氯化锡遇水强烈水解生成SnO2、HCl,SnO2是固体颗粒,HCl结合空气中的水蒸气,出现白色烟雾,故答案为:出现白色烟雾;
(6)依据所给信息:还原性Sn2+>I-,那么若产品中混有SnCl2,应能氧化碘离子生成碘单质,碘单质遇淀粉变蓝,故实验步骤为:取样品少许,溶于稀盐酸中,加2滴碘的淀粉溶液,振荡,若紫色褪去,说明SnCl4混有少量的SnCl2,否则SnCl4纯净,
故答案为:取样品少许,溶于稀盐酸中,加2滴碘的淀粉溶液,振荡,若紫色褪去,说明SnCl4混有少量的SnCl2,否则SnCl4纯净.
点评 本题主要考查的是制备实验方案的设计,综合性较强,难度较大,涉及知识点:实验室常见仪器、盐类水解原理、氧化还原反应原理等,充分利用所给信息是解决本题的关键.


 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低.
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
| A. | 4 s时容器内c(Y)=0.76 mol/L | |
| B. | 830℃达平衡时,X的转化率为80% | |
| C. | 反应达平衡后,升高温度,平衡正向移动 | |
| D. | 1200℃时反应R(g)+Q(g)?X(g)+Y(g)的平衡常数K=0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
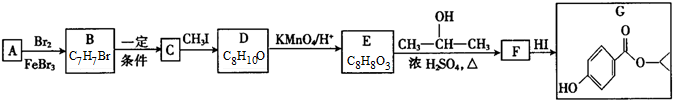
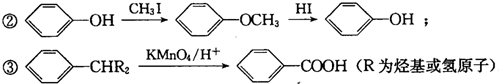
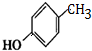 G的官能团名称为羟基和酯基
G的官能团名称为羟基和酯基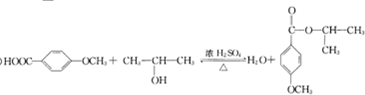
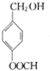
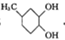

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 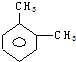 | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 前者大 | B. | 后者大 | C. | 一样大 | D. | 无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com