
 G的官能团名称为羟基和酯基
G的官能团名称为羟基和酯基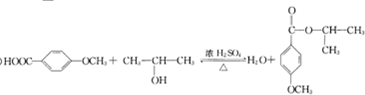

 .
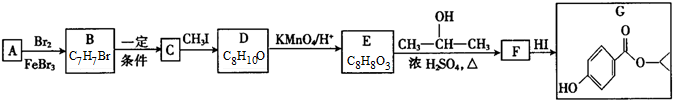
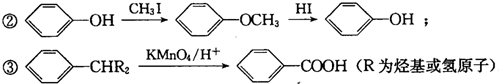
. 分析 根据题中各物质转化关系,C能与FeCl3溶液发生显色反应,说明C中有酚羟基,结合信息②可知反应C→D及反应F→G为酚羟基的保护,根据G的结构简式结合各步转化的条件以及各物质的分子式,可反推得F为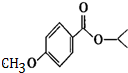 ,E为
,E为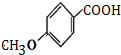 ,D为
,D为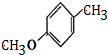 ,C为
,C为 ,B为
,B为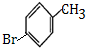 ,A为
,A为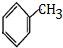 ,A发生苯环上的取代反应生成B,B发水解反应生成C,C发生取代反应生成D,D发生信息③中的氧化反应生成E,E发生酯化反应生成F,F发生取代反应生成G,由化合物C合成
,A发生苯环上的取代反应生成B,B发水解反应生成C,C发生取代反应生成D,D发生信息③中的氧化反应生成E,E发生酯化反应生成F,F发生取代反应生成G,由化合物C合成 ,可用C与氢气加成得K为
,可用C与氢气加成得K为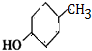 ,K再在浓硫酸作用下加热,发生消去反应得L为
,K再在浓硫酸作用下加热,发生消去反应得L为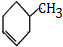 ,L再与溴或氯气发生加成反应得M为
,L再与溴或氯气发生加成反应得M为 ,M再发生水解反应可得
,M再发生水解反应可得 ,据此答题.
,据此答题.
解答 解:根据题中各物质转化关系,C能与FeCl3溶液发生显色反应,说明C中有酚羟基,结合信息②可知反应C→D及反应F→G为酚羟基的保护,根据G的结构简式结合各步转化的条件以及各物质的分子式,可反推得F为 ,E为
,E为 ,D为
,D为 ,C为
,C为 ,B为
,B为 ,A为
,A为 ,A发生苯环上的取代反应生成B,B发水解反应生成C,C发生取代反应生成D,D发生信息③中的氧化反应生成E,E发生酯化反应生成F,F发生取代反应生成G,
,A发生苯环上的取代反应生成B,B发水解反应生成C,C发生取代反应生成D,D发生信息③中的氧化反应生成E,E发生酯化反应生成F,F发生取代反应生成G,
(1)A为 ,A的名称是甲苯,C→D的反应类型为取代反应,
,A的名称是甲苯,C→D的反应类型为取代反应,
故答案为:甲苯;取代反应;
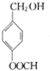
(2)C为 ,根据G的结构简式可知,G的官能团名称为羟基和酯基,
,根据G的结构简式可知,G的官能团名称为羟基和酯基,
故答案为: ;羟基和酯基;
;羟基和酯基;
(3)E→F的化学方程式为 ,
,
故答案为: ;
;
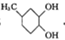
(4)E为 ,E的同分异构体,满足下列条件①能发生银镜反应和水解反应,说明有甲酸酯,②能和金属钠反应产生氢气,说明有羟基,③不能和FeCl3溶液发生显色反应,说明没有酚羟基,④属于芳香族化合物,说明有苯环,符合条件的结构为苯环上连有-CH2OH和HCOO-,它们有邻间对三种结构,另外也可以是苯环上连有HCOOCH(OH)-基团,所以共有4种,其中核磁共振氢谱中有5组峰,且峰面积之比为2:2:2:1:1的结构简式是
,E的同分异构体,满足下列条件①能发生银镜反应和水解反应,说明有甲酸酯,②能和金属钠反应产生氢气,说明有羟基,③不能和FeCl3溶液发生显色反应,说明没有酚羟基,④属于芳香族化合物,说明有苯环,符合条件的结构为苯环上连有-CH2OH和HCOO-,它们有邻间对三种结构,另外也可以是苯环上连有HCOOCH(OH)-基团,所以共有4种,其中核磁共振氢谱中有5组峰,且峰面积之比为2:2:2:1:1的结构简式是 ,
,
故答案为:4; ;
;
(5)由化合物C合成 ,可用C与氢气加成得K为
,可用C与氢气加成得K为 ,K再在浓硫酸作用下加热,发生消去反应得L为
,K再在浓硫酸作用下加热,发生消去反应得L为 ,L再与溴或氯气发生加成反应得M为
,L再与溴或氯气发生加成反应得M为 ,M再发生水解反应可得
,M再发生水解反应可得 ,所以反应条件1所选择的试剂为氢气,反应条件2所选择的试剂为浓硫酸,M的结构简式为
,所以反应条件1所选择的试剂为氢气,反应条件2所选择的试剂为浓硫酸,M的结构简式为 ,
,
故答案为:氢气;浓硫酸; .
.
点评 本题考查有机物合成和推断,是有机化学中的重要题型,有机合成过程主要包括官能团的引入、官能团的消除、官能团的衍变、碳骨架的变化等,注意有机基础知识的灵活运用.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01 kJ•mol-1 |
| 反应Ⅱ:2 CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52 kJ•mol-1 |
| 反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46 kJ•mol-1 |
| 反应Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸的化学式 | CH3COOH | HCN | H2S |
| 电离常数 | 1.8×10-4 | 4.9×10-11 | Ki=1.3×10-1 Kr=7.1×10-15 |
| A. | 等物质的量浓度的各溶液pH关系为pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | amol/LHCN与bmol/LNaOH溶液等体积混合,所得溶液中c(Na+)>c(CN-),则a一定小于或等于b | |
| C. | NaHS和Na2S的混合溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| D. | 某浓度的NaCN溶液的pH=d,则其中由水电离出的c(OH-)=10-dmol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锡有SnCl2、SnCl4两种氯化物.SnCl4是无色液体,极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃.实验室用熔融的金属锡跟干燥的氯气直接作用制取无水SnCl4(此反应过程放出大量的热).实验室制取无水SnCl4的装置如图所示.
锡有SnCl2、SnCl4两种氯化物.SnCl4是无色液体,极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃.实验室用熔融的金属锡跟干燥的氯气直接作用制取无水SnCl4(此反应过程放出大量的热).实验室制取无水SnCl4的装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜.当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )
如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,电极铝和镁都已除去表面氧化膜.当两装置电路中通过的电子都是1mol时,下列说法不正确的是( )| A. | 溶液的质量减小程度:乙<甲 | |
| B. | 溶液的导电能力变化:甲>乙 | |
| C. | 甲中阴极和乙中镁电极上析出物质质量:甲=乙 | |
| D. | 电极反应式:甲中阳极:2Cl--2e→Cl2↑,乙中正极:Cu2++2e→Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将SO2通入BaCl2溶液中 | B. | 将Cl2通入AgNO3溶液中 | ||
| C. | 将CO2通入Ba(OH)2溶液中 | D. | 将NO2通入Ca(OH)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期表是元素按原子序数从小到大从左到右排列而成的 | |
| B. | 主族元素原子的电子层数等于其所在周期的周期序数 | |
| C. | 四、五、六周期中都含有18种元素,其中Ⅷ族中所含元素种类最多 | |
| D. | 元素周期表中有18列、16个族,且第二列中无非金属元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com