
分析 列出三段式利用v=$\frac{△c}{△t}$求出v(O2),根据平衡常数K=$\frac{c(SO{\;}_{3})^{2}}{c(O{\;}_{2})c(S{O}_{2}){\;}^{2}}$及各组分的浓度计算出该反应的平衡常数,根据平衡常数仅与温度有关判断增大氧气浓度时平衡常数的变化;
解答 解:由 2SO2+O2 ?2SO3
?2SO3
开始(mol) 2 1 0
30s(mol) 0.2 0.1 0.2
平衡(mol) 1.8 0.9 0.2
所以v(O2)=$\frac{△c}{△t}$=$\frac{\frac{0.1mol}{2L}}{30s}$=$\frac{1}{600}$mol/(L•min),
K=$\frac{c(SO{\;}_{3})^{2}}{c(O{\;}_{2})c(S{O}_{2}){\;}^{2}}$=$\frac{(\frac{0.2}{2}){\;}^{2}}{\frac{0.9}{2}×(\frac{1.8}{2})^{2}}$=0.027,又平衡常数仅与温度有关,所以增大氧气浓度时平衡常数不变;
故答案为:$\frac{1}{600}$mol/(L•s);0.027;不变.
点评 本题侧重考查学生对有关反应速率计算以及平衡常数的计算的掌握,通常根据定义进行计算,注意平衡常数仅与温度有关.


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:填空题
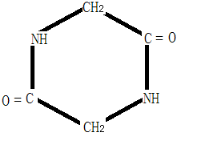 ,M与HCl反应的离子方程式为NH2CH2COOH+H+=
,M与HCl反应的离子方程式为NH2CH2COOH+H+=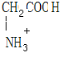 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数大小:X>Y | |
| B. | Xm+ 和Yn- 离子半径大小:r(Yn- )<r(Xm+) | |
| C. | 在周期表中X、Y在不同周期 | |
| D. | 在周期表中X、Y的族序数之差为:8-(m+n) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉类物质 | B. | 水 | C. | 脂肪类物质 | D. | 蛋白质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
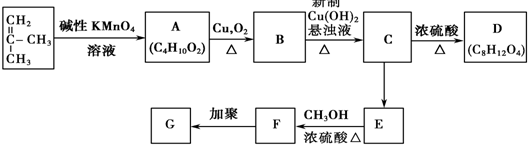
 ,G的结构简式是
,G的结构简式是 .
. +3Cu(OH)2$\stackrel{△}{→}$
+3Cu(OH)2$\stackrel{△}{→}$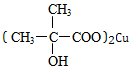 +Cu2O+4H2O.
+Cu2O+4H2O. +CH3OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3OH$→_{△}^{浓H_{2}SO_{4}}$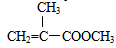 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 用工业酒精制无水乙醇选择装置③ | B. | 提纯含砂石的粗苯甲酸选择装置①② | ||
| C. | 从溴水中提纯溴选择装置④ | D. | 苯中混有少量溴苯选择装置③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl MgCl2 NH4Cl | B. | H2O Na2O ? CO2 | ||
| C. | NH3 H2O CO2 | D. | CaCl2 ? NaOH H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
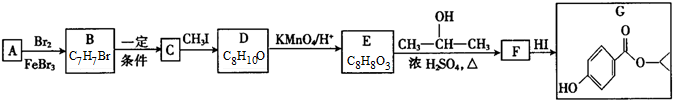
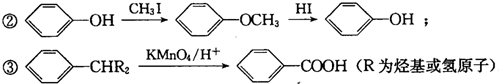
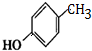 G的官能团名称为羟基和酯基
G的官能团名称为羟基和酯基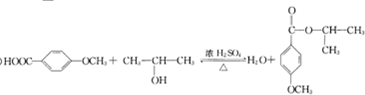
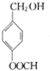
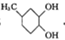

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com