
 CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低.
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低.分析 (1)①已知:CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-206kJ/mol (1)
CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-165kJ/mol (2)
利用盖斯定律将(1)-(2)书写计算;
②利用盖斯定律结合平衡常数K3=$\frac{c(H{\;}_{2})c(CO{\;}_{2})}{c(CO)c(H{\;}_{2}O)}$计算;
(2)根据甲烷化反应都为放热反应,温度升高,平衡向逆方向移动,则CO和H2的转化率都降低;又根据CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol 温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低;
(3)根据C(s)+2H2(g)=CH4(g)△H=-73kJ/mol(慢反应) (5),反应慢,所以反应过程中会出现碳过剩,热量传递不好而使催化剂烧结,失去催化作用;
(4)由图象作等温线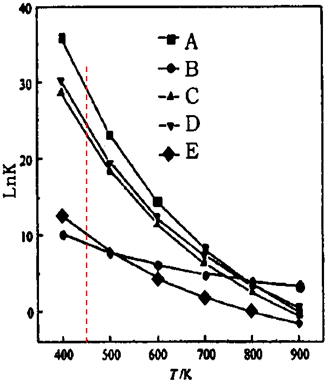 ,得450K时lnK3=ln$\frac{{K}_{1}}{{K}_{2}}$=lnK1-lnK2,所以A对应反应(1),C对应反应(2),B对应反应(3),据此分析.
,得450K时lnK3=ln$\frac{{K}_{1}}{{K}_{2}}$=lnK1-lnK2,所以A对应反应(1),C对应反应(2),B对应反应(3),据此分析.
解答 解:(1)①已知:CO(g)+3H2(g)=CH4(g)+H2O(g)△H=-206kJ/mol (1)
CO2(g)+4H2(g)=CH4(g)+2H2O(g)△H=-165kJ/mol (2)
利用盖斯定律将(1)-(2)可得:CO(g)+H2O(g)=CO2(g)+H2(g)△H=(-206+165)KJ/mol=-41kJ/mol,
故答案为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol;
②K3=$\frac{c(H{\;}_{2})c(CO{\;}_{2})}{c(CO)c(H{\;}_{2}O)}$=$\frac{\frac{c(CH{\;}_{4})c(H{\;}_{2}O)}{c(CO)c{\;}^{3}(H{\;}_{2})}}{\frac{c(CH{\;}_{4})c{\;}^{2}(H{\;}_{2}O)}{c(CO{\;}_{2})c{\;}^{4}(H{\;}_{2})}}$=$\frac{K{\;}_{1}}{K{\;}_{2}}$;故答案为:$\frac{K{\;}_{1}}{K{\;}_{2}}$;
(2)因为甲烷化反应都为放热反应,温度升高,平衡向逆方向移动,则CO和H2的转化率都降低;又根据CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol,温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低,
故答案为:降低;CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol,温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低;
(3)因为2个副反应2CO(g)=C(g)+CO2(g)△H=-171kJ/mol (快反应) (4)C(s)+2H2(g)=CH4(g)△H=-73kJ/mol(慢反应) (5),而(4)快(5)慢,所以反应过程中会出现碳固体结块现象,热量传递不好而使催化剂烧结,失去催化作用,故答案为:碳固体结块;
(4)由图象作等温线 ,得450K时lnK3=ln$\frac{{K}_{1}}{{K}_{2}}$=lnK1-lnK2,所以A对应反应(1),C对应反应(2),B对应反应(3),所以曲线A、B所对应的反应方程式编号为(1)(3),故答案为:(1)(3).
,得450K时lnK3=ln$\frac{{K}_{1}}{{K}_{2}}$=lnK1-lnK2,所以A对应反应(1),C对应反应(2),B对应反应(3),所以曲线A、B所对应的反应方程式编号为(1)(3),故答案为:(1)(3).
点评 本题主要考查了盖斯定律的应用,平衡移动原理及其平衡常数之间的关系,难度较大,注意图象信息的提取与应用.


科目:高中化学 来源: 题型:选择题
| A. | 钾的密度比钠的小 | B. | 加热时,钾比钠更易气化 | ||
| C. | 钾与水反应比钠与水反应更剧烈 | D. | 钾原子的电子层比钠原子多一层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用红外光谱可鉴别乙醇和二甲醚,用X-射线衍射实验可鉴别玻璃与水晶 | |
| B. | 煤的主要成分是单质碳、苯、二甲苯等,可通过煤的干馏将它们分离 | |
| C. | 聚氯乙烯塑料可制作保鲜膜、一次性食品袋 | |
| D. | 聚乙烯塑料的老化是由于发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g) | △H1=-49.01 kJ•mol-1 |
| 反应Ⅱ:2 CH3OH(g)?CH3OCH3(g)+H2O(g) | △H2=-24.52 kJ•mol-1 |
| 反应Ⅲ:CH3OCH3(g)?C2H4(g)+H2O(g) | △H3=-5.46 kJ•mol-1 |
| 反应Ⅳ:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g) | △H4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 锡有SnCl2、SnCl4两种氯化物.SnCl4是无色液体,极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃.实验室用熔融的金属锡跟干燥的氯气直接作用制取无水SnCl4(此反应过程放出大量的热).实验室制取无水SnCl4的装置如图所示.
锡有SnCl2、SnCl4两种氯化物.SnCl4是无色液体,极易水解,熔点-36℃,沸点114℃,金属锡的熔点为231℃.实验室用熔融的金属锡跟干燥的氯气直接作用制取无水SnCl4(此反应过程放出大量的热).实验室制取无水SnCl4的装置如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 ,⑤的形成过程用电子式表示为
,⑤的形成过程用电子式表示为 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com