
 ,⑤的形成过程用电子式表示为
,⑤的形成过程用电子式表示为 .
. 分析 (1)分子晶体熔化时不需要破坏化学键;
(2)含有离子键的化合物是离子化合物,活泼金属和活泼非金属元素之间易形成离子键,铵盐中含有离子键;非金属元素之间易形成共价键;
(3)氯化钡是离子晶体,钡离子和氯离子之间以离子键结合;干冰是分子晶体,二氧化碳分子中C原子和O原子之间以共价键结合.
解答 解:(1)分子晶体熔化时不需要破坏化学键,只破坏分子间作用力,干冰和碘片都属于分子晶体,熔化时不需要破坏化学键;
故答案为:②⑤;
(2)含有离子键的化合物是离子化合物,则属于离子化合物的是:BaCl2、NH4Cl、Na2SO4,只含有离子键的是BaCl2,
故答案为:①③④;①;
(3)氯化钡是离子晶体,钡离子和氯离子之间以离子键结合,氯化钡的电子式为 ;干冰是分子晶体,二氧化碳分子中C原子和O原子之间以共价键结合,二氧化碳电子式为
;干冰是分子晶体,二氧化碳分子中C原子和O原子之间以共价键结合,二氧化碳电子式为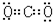 ,则形成过程为:
,则形成过程为: ,
,
故答案为: .
.
点评 本题考查化学键、分子间作用力,明确基本概念及基本理论即可解答,注意原子晶体和分子晶体熔化的区别,注意离子化合物和共价化合物电子式书写区别,题目难度不大.


科目:高中化学 来源: 题型:填空题
 CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低.
CO(g)+H2O(g)=CO2(g)+H2(g)△H=-41kJ/mol温度升高,平衡向逆方向移动,进一步消耗了氢气而生成了CO,使CO转化率更低.查看答案和解析>>
科目:高中化学 来源: 题型:填空题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 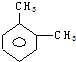 | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把电能转变为化学能的装置 | |
| B. | 活泼金属做正极,不活泼金属或非金属做负极 | |
| C. | 外电路中电子从负极流向正极 | |
| D. | 正极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入水时,平衡向逆反应方向移动 | |
| B. | 加入少量NaOH固体,平衡向正反应方向移动 | |
| C. | 加入少量0.1 mol•L-1 HCl溶液,溶液中c(H+)不变 | |
| D. | 加入少量CH3COONa固体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅦA族元素形成的单质的熔点随元素原子序数增大而升高 | |
| B. | ⅦA族元素易形成-1价离子 | |
| C. | 最高价氧化物的水化物显酸性 | |
| D. | 从上到下气态氢化物的稳定性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 前者大 | B. | 后者大 | C. | 一样大 | D. | 无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
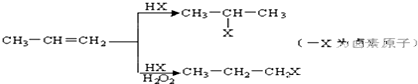
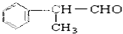 的物质,它是一种香料.
的物质,它是一种香料.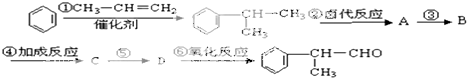
 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com