
某企业以辉铜矿为原料生产碱式碳酸铜,工艺流程如下所示:
已知:[Cu(NH3)4]2+(aq)  Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
Cu2+(aq) + 4NH3(aq)根据以上工艺流程,下列说法不正确的是
| A.气体X中含有SO2 |
| B.为实现溶液C到溶液D的转化,加NH3·H2O至红棕色沉淀刚好完全,过滤即可 |
C.蒸氨过程发生总反应的化学方程式为:[Cu(NH3)4 ]Cl2 + H2O CuO + 2HCl↑+ 4NH3↑ CuO + 2HCl↑+ 4NH3↑ |
| D.在制备产品时,溶液D中不直接加入Na2CO3溶液的原因是游离的Cu2+浓度太低 |
科目:高中化学 来源: 题型:填空题
镁及其合金是一种用途很广的金属材料,海水中镁的含量为1.10 mg·L-1,目前世界上60%的镁是从海水中提取的。主要步骤如下:
(1)为了使MgSO4完全转化为Mg(OH)2,可以加入过量试剂①,试剂①最好选用 。
(2)加入试剂①后,能够分离得到Mg(OH)2沉淀的方法是 。
(3)试剂②可以选用 ,其反应的离子方程式为 。
(4)无水MgCl2在熔融状态下,通电后会产生Cl2和Mg,写出该反应的化学方程式 。
(5)若假设海水中镁元素全部存在于MgSO4中,则海水中MgSO4的含量为 mg·L-1,若某工厂每天生产1.00 t镁,则每天需要海水的体积为 L。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
从海水制备金属镁的流程如图所示:
(1)为了节约成本,充分利用海滩资源,用贝壳经过一系列反应可以制得石灰乳,请写出有关反应的化学方程式:__________;__________。
(2)向石灰乳中加入MgCl 溶液,充分搅拌、过滤、洗涤。写出该反应的化学方程式:__________。
溶液,充分搅拌、过滤、洗涤。写出该反应的化学方程式:__________。
(3)从熔点与硬度方面来看,镁合金与镁相比较,其特点有__________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
精细化学品具有品种多、批量少、产值高的特点。
(1)表面活性剂在工农业生产和日常生活中广泛应用,其优点是______________,能显著降低水与空气或其他物质的________,提高工业生产________,提高产品的________,故表面活性剂被称为_________________。
(2)在泡沫灭火器中添加表面活性剂可以提高灭火效果的原因是什么?
(3)精细化学品具有特定的功能,特殊的用途,如有些洗衣粉适用于洗衣机,加酶洗衣粉不能用于洗涤____________,医药和农药都有严格的________、__________等。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
过氧化钙(CaO2)难溶于水,在常温下稳定,在潮湿空气及水中缓慢分解放出氧气,因而广泛应用于渔业、农业、环保等许多方面。下图是以大理石(主要杂质是氧化铁)等为原料制取过氧化钙(CaO2)的流程。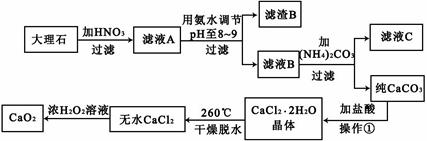
请回答下列问题:
(1)用氨水调节pH至8——9的目的是 。
(2)若测得滤液C中c(CO32-)=10-3mol/L,则Ca2+ (填“是”或“否”)沉淀完全。(已知c(Ca2+)≤10-5mol/L可视为沉淀完全;Ksp(CaCO3)=4.96×10-9)
(3)若在滤液C中,加入HNO3使溶液呈酸性以得到副产物NH4NO3,则酸化后溶液中,c(NH4+) c(NO3-)(填“≥”、“≤”、“<”、“>”或“=”)。
(4)在低温下,往过氧化氢浓溶液中投入无水氯化钙进行反应,写出该反应的化学方程式: ,一段时间后,再加入氢氧化钠溶液,当调节溶液pH至9——11,才出现大量沉淀。用化学方程式和简要的文字解释需用氢氧化钠调节pH至9——11的原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
回收再利用锗产品加工废料,是生产GeO2的重要途径,其流程如下图:
(1)Ge2+与氧化剂H2O2反应生成Ge4+,写出该反应的离子方程式 。
(2)蒸馏可获得沸点较低的GeCl4,在此过程中加入浓盐酸的原因是 。实验室蒸馏操作时常用的玻璃仪器有:酒精灯、蒸馏烧瓶、 、 、接收管、锥形瓶等。
(3)GeCl4水解生成GeO2·nH2O,此过程用化学方程式可表示为 。
温度对GeCl4的水解率产生的影响如图1所示,其原因是 。 为控制最佳的反应温度,实验时可采取的措施为 (填序号)。
A.用冰水混合物 B.49℃水浴 C.用冰盐水
(4)结合Ge在元素周期表中的位置及“对角线”法则,分析GeO2溶解率随pH 变化的原因 ,用离子方程式表示pH>8时GeO2溶解率增大可能发生的反应 。
| pH | 4 | 5 | 6 | 7 | 8 | 9 |
| 溶解率/% | 47.60 | 32.53 | 11.19 | 5.27 | 1.96 | 8.85 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3+N2+3C=2AlN+3CO,下列叙述正确的是( )。
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中每生成2 mol AlN,N2得到3 mol电子 |
| C.氮化铝中氮元素的化合价为-3价 |
| D.氮化铝属于复合材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com