
【题目】完成下面各题:
(1)向30毫升1mol/L的AlCl3溶液中逐渐加入浓度为2mol/L的NaOH溶液,若产生0.78克白色沉淀,则加入的NaOH溶液的体积可能为 .
(2)某溶液中有①NH4+、②Mg2+、③Fe2+、④Al3+四种离子,若向其中加入过量的氢氧化钠溶液,微热并搅拌,再加入过量盐酸,溶液中大量减少的阳离子是 .
A.①②
B.②③
C.①③
D.③④
(3)把Ba(OH)2溶液滴入明矾溶液中,使SO42﹣全部转化成BaSO4沉淀,此时铝元素的主要存在形式是 .
【答案】
(1)15毫升或55毫升
(2)C
(3)AlO2﹣
【解析】解:(1)n(AlCl3)=0.03 mol,n[Al(OH)3]=0.01 mol,由沉淀的物质的量小于氯化铝的物质的量可推知此题可能有两个答案:一是氢氧化钠不足,二是氢氧化钠过量;由两者反应的离子方程式知Al3++3OH﹣═Al(OH)3↓、Al(OH)3+OH﹣═AlO2﹣+2H2O知,当碱的量不足时,只发生反应Al3++3OH﹣═Al(OH)3↓,根据氢氧化铝和氢氧根离子之间的关系式得,则V(NaOH)= ![]() =15mL;当碱过量时,生成氢氧化铝发生的反应为Al3++3OH﹣═Al(OH)3↓,根据氢氧化铝和氢氧根离子之间的关系式得,则V(NaOH)=
=15mL;当碱过量时,生成氢氧化铝发生的反应为Al3++3OH﹣═Al(OH)3↓,根据氢氧化铝和氢氧根离子之间的关系式得,则V(NaOH)= ![]() =15mL;根据铝离子守恒得n(AlO2﹣)=0.03mol﹣0.01mol=0.02mol,发生的反应为Al3++4OH﹣═AlO2﹣+2H2O,根据方程式知,生成偏铝酸根离子需要氢氧化钠体积=
=15mL;根据铝离子守恒得n(AlO2﹣)=0.03mol﹣0.01mol=0.02mol,发生的反应为Al3++4OH﹣═AlO2﹣+2H2O,根据方程式知,生成偏铝酸根离子需要氢氧化钠体积= ![]() =40mL,所以共加入的NaOH溶液的体积为40+15=55ml,所以答案是:15毫升或55毫升;(2)加入过量的氢氧化钠溶液,微热并搅拌,四种离子均反应,铝离子转化为偏铝酸根离子,再加盐酸,又转化为铝离子,镁离子转化为沉淀后再与盐酸反应生成镁离子,则②④中离子浓度不变,而铵根离子与NaOH反应生成氨气,亚铁离子转化为沉淀后被氧化生成氢氧化铁,与盐酸反应生成铁离子,则①③中离子浓度减小,故选C;(3)明矾的化学式为KAl(SO4)212H2O,设明矾为1mol,则溶液中含有1molAl3+ , 2molSO42﹣ , 由反应SO42﹣+Ba2+=BaSO4↓可知,使SO42﹣全部转化成BaSO4沉淀,需要2molBa(OH)2 , 则加入4molOH﹣ , 则发生Al3++4OH﹣=AlO2﹣+2H2O,所以最后溶液中存在AlO2﹣ , 所以答案是:AlO2﹣ .
=40mL,所以共加入的NaOH溶液的体积为40+15=55ml,所以答案是:15毫升或55毫升;(2)加入过量的氢氧化钠溶液,微热并搅拌,四种离子均反应,铝离子转化为偏铝酸根离子,再加盐酸,又转化为铝离子,镁离子转化为沉淀后再与盐酸反应生成镁离子,则②④中离子浓度不变,而铵根离子与NaOH反应生成氨气,亚铁离子转化为沉淀后被氧化生成氢氧化铁,与盐酸反应生成铁离子,则①③中离子浓度减小,故选C;(3)明矾的化学式为KAl(SO4)212H2O,设明矾为1mol,则溶液中含有1molAl3+ , 2molSO42﹣ , 由反应SO42﹣+Ba2+=BaSO4↓可知,使SO42﹣全部转化成BaSO4沉淀,需要2molBa(OH)2 , 则加入4molOH﹣ , 则发生Al3++4OH﹣=AlO2﹣+2H2O,所以最后溶液中存在AlO2﹣ , 所以答案是:AlO2﹣ .


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
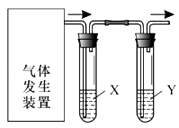
【题目】实验室用如图装置完成下表所列的四个实验,不能达到实验目的是( )
选项 | 实验目的 | 试剂X | 试剂Y |
A | 验证C2H5OH与浓H2SO4加热至170℃制得的乙烯的性质 | NaOH溶液 | Br2水 |
B | 检验FeSO4受热分解产生的气体中由SO3和SO2 | BaCl2溶液 | 品红溶液 |
C | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
D | 验证氧化性:Cl2>Br2>I2 | NaBr溶液 | KI溶液 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为提纯下列物质(括号内的物质为杂质),所选用的除杂试剂和分离方法都正确的是( )
选项 | A | B | C | D |
被提纯物质 | 乙醇(水) | 乙醇(乙酸) | 乙烷(乙烯) | 溴苯(溴) |
除杂试剂 | 生石灰 | 氢氧化 钠溶液 | 酸性高锰 酸钾溶液 | KI溶液 |
分离方法 | 蒸馏 | 分液 | 洗气 | 分液 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学反应,下列叙述中不正确的是( ) ①放热的反应发生时不必加热
②化学反应一定有能量变化
③吸热反应需要加热后才能发生
④化学反应热效应数值(放出或吸收的热量)与参加反应的物质的多少有关.
A.①②
B.②③
C.①③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--选修2:化学与技术]高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等.以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
回答下列问题:
(1)原料软锰矿与氢氧化钾按1:1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是 .
(2)“平炉”中发生的化学方程式为 .
(3)“平炉”中需要加压,其目的是 .
(4)将K2MnO4转化为KMnO4的生产有两种工艺.
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱碱性,K2MnO4发生歧化反应,反应中生成KMnO4 , MnO2和(写化学式).
②“电解法”为现代工艺,即电解K2MnO4水溶液,电解槽中阳极发生的电极反应为
, 阴极逸出的气体是 .
③“电解法”和“CO2歧化法”中,K2MnO4的理论利用率之比为 .
(5)高锰酸钾纯度的测定:称取1.0800g样品,溶解后定容于100mL容量瓶中,摇匀.取浓度为0.2000molL﹣1的H2C2O4标准溶液20.00mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48mL,该样品的纯度为(列出计算式即可,已知2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X,Y,Z,W,Q,R均为前四周期元素,且原子序数依次增大,其相关信息如表所示:
X的基态原子中电子分布在三个不同的能级中且每个能级中电子总数相同 |
Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化合反应 |
Z元素的族序数是周期数的三倍 |
W原子的第一至第六电离能分别为: |
Q为前四周期中电负性最小的元素 |
R位于周期表中的第11列 |
(1)R基态原子的价电子排布图为 , R在周期表中位于区.
(2)X,Y,Z的第一电离能由大到小的顺序为(用元素符号表示).
(3)含有元素Q的盐的焰色反应为色,许多金属盐都可以发生焰色反应,其原因是 .
(4)Q单质形成的晶体的堆积模型为 , 配位数是 .
(5)光谱证实单质W与强碱溶液反应有[W(OH)4]﹣生成,则[W(OH)4]﹣中存在(填字母).
a.极性共价键 b.非极性共价键 c.配位键 d.σ键 e.π键.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据图中包含的信息分析,下列叙述正确的是( ) 
A.氢气与氯气反应生成1 mol氯化氢气体,反应吸收248 kJ的能量
B.436 kJ/mol是指断开1 mol H2中的H﹣H键需要放出436 kJ的能量
C.氢气与氯气反应生成2 mol氯化氢气体,反应放出183 kJ的能量
D.431kJ/mol是指生成2 mol HCl中的H﹣Cl键需要放出431 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
A.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl﹣个数为NA
B.常温常压下,1.06gNa2CO3含有的Na+数为0.02NA
C.通常状况下,NA个CO2分子占有的体积为22.4L
D.标准状况下,22.4LH2O含有的分子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com