
����Ŀ������þ���Ͻ�(Mg17Al12 )��һ��DZ�ڵ�������ϣ�������������£���һ����ѧ�����ȵ�Mg��Al ������һ���¶���������á��úϽ���һ����������ȫ����ķ�Ӧ����ʽΪ��Mg17Al12 + 17H2=17MgH2 + 12Al���õ��Ļ����Y(17MgH2 +12Al)��һ�������¿��ͷų�������
�� �����Ʊ�þ���Ͻ�(Mg17Al12)ʱͨ�������Ŀ����
�� ��6.0 mol��L��1 HCl ��Һ�У������Y ����ȫ�ͷų�H2��1 mol Mg17Al12 ��ȫ�����õ��Ļ����Y ������������ȫ��Ӧ���ͷų�H2�����ʵ���Ϊ
����ijһ��Ӧ��ϵ�з�Ӧ��������ﹲ�������ʣ�
O2��H2CrO4��Cr(OH)3��H2O��H2O2
��֪�÷�Ӧ��H2O2ֻ�������¹��̣�H2O2�D��O2
�� �÷�Ӧ�еĻ�ԭ����
�� �÷�Ӧ�У�������ԭ��Ӧ�Ĺ����� ��
�� д���÷�Ӧ�Ļ�ѧ����ʽ�����������ת�Ƶķ������Ŀ ��
�� ����Ӧת����0.3 mol���ӣ�������������ڱ�״�������Ϊ
���𰸡�
��������ֹMg��Al��������������52mol��
������H2O2����H2CrO4��Cr(OH)3��
��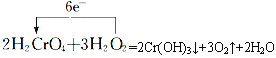 ��
��
��3.36
��������
�������������(1)þ�������ǻ��õĽ������ʣ����ױ������е�����������ͨ����������������Է�ֹ���߱��������ʴ�Ϊ����ֹMg Al������������
(2)1molMg17Al12��ȫ����17mol���������л�ȫ���ͷų�����þ���Ͻ��е�þ�������������ᷴӦ����H2���������������ʵ����ֱ�Ϊ17mol��18mol������������һ��(17+17+12��![]() )mol=52mol���ʴ�Ϊ��52mol��
)mol=52mol���ʴ�Ϊ��52mol��
����(1)����ϢH2O2-��O2�п�֪��OԪ�صĻ��ϼ���-1�����ߵ�0����H2O2Ϊ��ԭ�����ʴ�Ϊ��H2O2��
(2)������������ԭ��Ӧ����Ԫ�ػ��ϼ۽��͵�����Ϊ����������CrԪ�صĻ��ϼ۽��ͣ�����ԭ��Ӧ�Ĺ���ΪH2CrO4��Cr(OH)3���ʴ�Ϊ��H2CrO4��Cr(OH)3��
(3)�÷�Ӧ��OԪ��ʧ���ӣ�CrԪ�صõ����ӣ�2molH2CrO4��Ӧת�Ƶ���Ϊ2mol��(6-3)=6mol�����õ����ŷ��������ת�Ƶķ������ĿΪ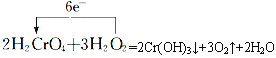 ���ʴ�Ϊ��
���ʴ�Ϊ��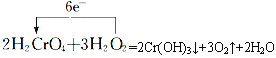 ;
;
(4)��2H2CrO4+3H2O2�T2Cr(OH)3��+3O2��+2H2O��֪������3mol����ת��6mol���ӣ���ת����0.3mol���ӣ����������������ʵ���Ϊ![]() ��3mol=0.15mol�����ڱ�״�������Ϊ0.15mol��22.4L/mol=3.36L���ʴ�Ϊ��3.36��
��3mol=0.15mol�����ڱ�״�������Ϊ0.15mol��22.4L/mol=3.36L���ʴ�Ϊ��3.36��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ϣ�Ԫ�ظ�(Cr)����Һ����Ҫ��Cr3+(����ɫ)��Cr(OH)4(��ɫ)��Cr2O72(�Ⱥ�ɫ)��CrO42(��ɫ)����ʽ���ڣ�Cr(OH)3Ϊ������ˮ�Ļ���ɫ���壬�ش��������⣺
��1������24Cr������_______________��ѡ���ţ���
a������Ԫ�� b������Ԫ�� c������Ԫ�� d������Ԫ��
��2��������������ɫ�н�������Ĺ��壬�нϸߵ��۵㣬����Ӳ�Ľ�������Ni�����ӵ�Fe�п��Ƴɲ���֡��Ƚ�Ӳ�ȣ�����_________����֣��۵㣺����__________����֣��>����<����=������
��3��Cr(OH)3��Al(OH)3�Ļ�ѧ�������ơ���Cr2(SO4)3��Һ����μ���NaOH��Һֱ���������ɹ۲쵽��������___________________��
��4��CrO42��Cr2O72����Һ�п��ת���������£���ʼŨ��Ϊ1.0 mol��L1��Na2CrO4��Һ��c(Cr2O72)��c(H+)�ı仯��ͼ��ʾ��
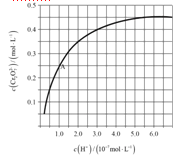
�������ӷ���ʽ��ʾNa2CrO4��Һ�е�ת����Ӧ____________________��
����ͼ��֪����Һ��������CrO42��ƽ��ת����__________(�������С�����䡱)������A�����ݣ��������ת����Ӧ��ƽ�ⳣ��Ϊ__________��
�������¶ȣ���Һ��CrO42��ƽ��ת���ʼ�С����÷�Ӧ�Ħ�H__________0(�>����<����=��)��
��5��+6�۸��Ļ����ﶾ�Խϴ��仯������;�㷺���磺���ƾ�����ǡ��ɼ��˾���Ƿ�Ƽݣ��䷴Ӧԭ��Ϊ��m C2H5OH+ n X + p H2SO4�T g Cr2(SO4)3 + w CO2��+ 9H2O������X�Ļ�ѧʽ���п���Ϊ__________������NaHSO3�����Է�Һ�е�Cr2O72��ԭ��Cr3+���÷�Ӧ�����ӷ���ʽΪ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Cyrneine A��������ϵͳ�������źܺõ���Ч����������ͪ�����ಽ��Ӧ�ϳɣ� ������˵������ȷ������ ��
������˵������ȷ������ ��
A������ͪ�ķ���ʽΪC10H14O
B��Cyrneine A���Է����ӳɷ�Ӧ����ȥ��Ӧ��������Ӧ
C������ͪ��Cyrneine A����ʹ����KMnO4��Һ��ɫ
D��������ͪ��Ϊͬ���칹�壬��������4�ֲ�ͬ��ѧ��������ԭ�ӵķ�����ﹲ��3��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ�鷽����װ����ȷ���ǣ� ��

A. ��ͼ1��ʾװ����ȡ��ϩ
B. ��ͼ2��ʾ������֤HCl����������ˮ
C. ��ͼ3��ʾ����̽�����������Է�Ӧ���ʵ�Ӱ��
D. ��ͼ4��ʾ����������������NaOH����Һ���Ȳ�����ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� 0.4mol/L AgNO3 ��Һ��0.3mol/L MgCl2 ��Һ�� 0.2mol/L �� AlCl3 ��Һ�� 3��2��1 ��������Ͼ��ú� �ϲ���ҹ�� Cl-��Ũ��Ϊ����Ϻ���Һ����仯���ƣ�
A. 0.2mol/L B. 0.1mol/L C. 0.6mol/L D. 0.3mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʽ��ͬ�����Ȳ���ͬϵ��ֲ���ͬ���칹����ǣ� ��
A. ��ϩ��3��1��ϩ B. ������Ȳ
C. 1�ȱ����2�ȱ��� D. ��������ͼ�Ȳ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ������ ��
A��40g̼���辧���к��е�C��Si����ĿΪ2NA
B��1L 1 mol��L��1 AlCl3��Һ�к��е�Al3+��ĿΪNA
C��0.1mol���ڵ�NaHSO4�к��е�������Ϊ0.2 NA��
D���ڱ������11.2L HCHO�к��Цм�����ĿΪ0.5NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ƽ����ϵ�У����»��ѹ����ʹƽ��������Ӧ�����ƶ����ǣ� ��
A. N2(g)��3H2(g)![]() 2NH3(g) ��H <0
2NH3(g) ��H <0
B. N2(g)��O2(g)![]() 2NO(g) ��H <0
2NO(g) ��H <0
C. C(s)��2H2O(g)![]() CO2(g)��2H2(g) ��H >0
CO2(g)��2H2(g) ��H >0
D. 2SO2(g)��O2(g)![]() 2SO3(g) ��H <0
2SO3(g) ��H <0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25����1.01��105Pa�£���22gCO2ͨ�뵽750mL1.0mol/L��NaOH��Һ�г�ַ�Ӧ���ų�xkJ��������֪�������£�1mol CO2ͨ�뵽2L1.0mol/LNaOH��Һ�г�ַ�Ӧ���ų�y kJ����������CO2��NaOH��Һ��Ӧ����NaHCO3���Ȼ�ѧ����ʽ��ȷΪ
A. CO2��g��+NaOH��aq��=NaHCO3��aq����H=����2y-x��kJ/mol
B. CO2��g��+NaOH��aq��=NaHCO3��aq����H=����4x-y��kJ/mol
C. CO2��g��+NaOH��aq��=NaHCO3��aq����H=����2x-y��kJ/mol
D. CO2��g��+NaOH��aq��=2NaHCO3��aq����H=����8x-2y��kJ/mol
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com