
【题目】将 0.4mol/L AgNO3 溶液,0.3mol/L MgCl2 溶液和 0.2mol/L 的 AlCl3 溶液按 3:2:1 的体积相混合静置后, 上层清夜中 Cl-的浓度为(混合后溶液体积变化不计)
A. 0.2mol/L B. 0.1mol/L C. 0.6mol/L D. 0.3mol/L
【答案】B
【解析】试题分析:根据题意,先设三种溶液的体积分别为3 x L、2 x L、x L,再由cV可知三种溶液中溶质的n分别为1.2 x mol、0.6x mol、0.2 x mol,然后由电离方程式或关系式:AgNO3= Ag++ NO3-、MgCl2= Mg2++ 2Cl-、AlCl3= Al3++ 3Cl-可知,Ag+、Cl-分别为1.2x mol、1.2x mol、0.6x mol,再由离子方程式Ag++ Cl- = AgCl↓可知,1.2x molAg+恰好与1.2x mol Cl- 反应,过量的 Cl- 为0.6x mol,最后由混合后溶液的体积不变、![]() 可知,c(Cl-) =
可知,c(Cl-) =![]() ="0.1" mol/L,B正确;答案选B。
="0.1" mol/L,B正确;答案选B。


科目:高中化学 来源: 题型:
【题目】【化学—选修3:物质结构与性质】人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”.试回答下列问题:
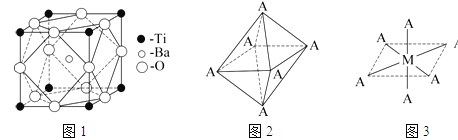
(1)Ti元素原子序数为22,它在元素周期表中的位置是第 周期第 族;其基态原子的电子排布式为 。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定.偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图1所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 。
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点﹣23.2℃,沸点136.2℃,所以TiCl4应是
化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如图2所示,我们通常可以用图3所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体,请将其结构画出_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天津港“8.12”特大火灾爆炸事故,造成了极其恶劣的社会影响。原因是化学危险 品随意堆放,管理人员安全意识淡漠,对人民的生命财产极不负责任。
下面是其中一部分危险品。请回答下列问题:
⑴ 写出过氧化氢的电子式
⑵ 上述危险品中,和水反应且符合下列条件的离子方程式
① 属于氧化还原反应 ② 水既不做氧化剂也不做还原剂
⑶ 4000C时,硝酸铵会发生爆炸,生成氮气、二氧化氮和水蒸气,20g硝酸铵爆炸放出QkJ的热量,试写出该反应的热化学方程式
⑷ 写出酸性高锰酸钾溶液与过氧化氢化应的离子方程式
⑸ 氰化钠有剧毒,为防止扩散,消防队员和工作人员离场前都用双氧水消毒。氰化钠和双氧水反应生成一种酸式盐和一种有刺激性气味的气体,反应的离子方程式是 ;调查查明现场有700吨的氰化钠,如果用密度为1.2g/mL质量分数为17%的双氧水进行消毒,最少需要这种双氧水_______L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修3: 物质结构与性质】
钛、铬、铁、镍、铜等金属及其化合物在工业上有重要用途。
(1)钛铁合金是钛系储氢合金的代表,该合金具有放氢温度低、价格适中等优点。
① Ti的基态原子价电子排布式为 。
② Fe的基态原子共有 种不同能级的电子。
(2)制备CrO2Cl2的反应为K2Cr2O7+3 CCl4==="2" KCl+2 CrO2Cl2+3 COCl2↑。
① 上述化学方程式中非金属元素电负性由大到小的顺序是 (用元素符号表示)。
② COCl2分子中所有原子均满足8电子构型,COCl2分子中σ键和π键的个数比为 ,中心原子的杂化方式为 。
(3)NiO、FeO的晶体结构均与氯化钠的晶体结构相同,其中Ni2+和Fe2+的离子半径分别为6.9×10-2nm和7.8×10-2nm。则熔点:NiO (填“>”、“<”或“=”)FeO。
(4)Ni和La的合金是目前使用广泛的储氢材料,具有大容量、高寿命、耐低温等特点,在日本和中国已实现了产业化。该合金的晶胞结构如图所示。

①该晶体的化学式为 。
②已知该晶胞的摩尔质量为M g·mol-1,密度为d g·cm-3。设NA为阿伏加德罗常数的值,则该晶胞的体积是 cm3(用含M、d、NA的代数式表示)。
③该晶体的内部具有空隙,且每个晶胞的空隙中储存6个氢原子比较稳定。已知:a=511 pm,c=397 pm;标准状况下氢气的密度为8.98×10-5 g·cm-3;储氢能力=![]() 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.镁铝合金(Mg17Al12 )是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为:Mg17Al12 + 17H2=17MgH2 + 12Al。得到的混合物Y(17MgH2 +12Al)在一定条件下可释放出氢气。
⑴ 熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是
⑵ 在6.0 mol·L-1 HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17Al12 完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2的物质的量为
Ⅱ.某一反应体系有反应物和生成物共五种物质:
O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知该反应中H2O2只发生如下过程:H2O2―→O2
⑴ 该反应中的还原剂是
⑵ 该反应中,发生还原反应的过程是 →
⑶ 写出该反应的化学方程式,并标出电子转移的方向和数目 ;
⑷ 若反应转移了0.3 mol电子,则产生的气体在标准状况下体积为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去),则W、X不可能是
选项 | W |
|
A | 稀硫酸 | NaAlO2溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中加入4 mol A、1.2 mol C和一定量的B三种气体,一定条件下发生反应,各物质的浓度随时间变化如甲图所示[已知t0~t1阶段保持恒温、恒容,且c(B)未画出]。乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,已知在t2、t3、t4、t5时刻各改变一种不同的条件,其中t3时刻为使用催化剂。

(1)若t1=15 s,则t0~t1阶段的反应速率为v(C)=___________。
(2)t4时刻改变的条件为____________,B的起始物质的量为______________。
(3)t5时刻改变的条件为____________,该反应的逆反应为__________(填“吸热反应”或“放热反应”)。
(4)图乙中共有Ⅰ~Ⅴ五处平衡,其平衡常数最大的是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx,形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)在鼓泡反应器中通入含有含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×103mol·L1。反应一段时间后溶液中离子浓度的分析结果如下表:
离子 | SO | SO | NO | NO | Cl |
c/(mol·L1) | 8.35×104 | 6.87×106 | 1.5×104 | 1.2×105 | 3.4×103 |
①写出NaClO2溶液脱硝过程中主要反应的离子方程式__________增加压强,NO的转化率__________(填“提高”“不变”或“降低”)。
②随着吸收反应的进行,吸收剂溶液的pH逐渐______________(填“增大”“不变”或“减小”)。
③由实验结果可知,脱硫反应速率__________脱硝反应速率(填“大于”或“小于”)。原因是除了SO2和NO在烟气中的初始浓度不同,还可能是___________。
(2)在不同温度下,NaClO2溶液脱硫、脱硝的反 应中,在反应ClO![]() +2SO
+2SO![]() ==2SO
==2SO![]() +Cl的平衡常数K表达式为__________。
+Cl的平衡常数K表达式为__________。
(3)如果采用NaClO、Ca(ClO)2替代NaClO2,也能得到较好的烟气脱硫效果。已知下列反应:
SO2(g)+2OH(aq)==SO![]() (aq)+H2O(l)ΔH1
(aq)+H2O(l)ΔH1
ClO(aq)+SO![]() (aq)==SO
(aq)==SO![]() (aq)+Cl(aq)ΔH2
(aq)+Cl(aq)ΔH2
CaSO4(s)==Ca2+(aq)+SO![]() (aq)ΔH3
(aq)ΔH3
则反应SO2(g)+Ca2+(aq)+ClO(aq)+2OH(aq)==CaSO4(s)+H2O(l)+Cl(aq)的ΔH=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com