
【题目】密闭容器中加入4 mol A、1.2 mol C和一定量的B三种气体,一定条件下发生反应,各物质的浓度随时间变化如甲图所示[已知t0~t1阶段保持恒温、恒容,且c(B)未画出]。乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,已知在t2、t3、t4、t5时刻各改变一种不同的条件,其中t3时刻为使用催化剂。

(1)若t1=15 s,则t0~t1阶段的反应速率为v(C)=___________。
(2)t4时刻改变的条件为____________,B的起始物质的量为______________。
(3)t5时刻改变的条件为____________,该反应的逆反应为__________(填“吸热反应”或“放热反应”)。
(4)图乙中共有Ⅰ~Ⅴ五处平衡,其平衡常数最大的是__________。
【答案】
(1)0.02mol·L-1·s-1
(2)减小压强;2mol
(3)升高温度;放热反应;
(4)Ⅴ
【解析】
试题分析:(1)若t1=15min,生成物C在t0~t1时间段的平均反应速率为:v=![]() =
=![]() =0.02molL-1min-1,故答案为:0.02molL-1min-1;
=0.02molL-1min-1,故答案为:0.02molL-1min-1;
(2)t4~t5阶段改变条件后,正逆反应速率都减小且相等,所以不可能是降低温度,应该为减小压强;反应中A的浓度变化为:1mol/L-0.8mol/L=0.2mol/L,C的浓度变化为:0.6mol/L-0.3mol/L=0.3mol/L,反应中A与C的化学计量数之比为0.2:0.3=2:3,根据t4~t5阶段改变压强平衡不移动可知,该反应的方程式为2A(g)+B(g)![]() 3C(g);由方程式可知反应过程中消耗的B的物质的量浓度为:(1 mol/L - 0.8 mol/L) ×
3C(g);由方程式可知反应过程中消耗的B的物质的量浓度为:(1 mol/L - 0.8 mol/L) × ![]() = 0.1mol/L,所以B的起始浓度为0.4mol/L+0.1mol/L=0.5mol/L,向某密闭容器中加入4mol A、1.2mol C和一定量的B三种气体,A的起始浓度为1.0mol/L,体积=
= 0.1mol/L,所以B的起始浓度为0.4mol/L+0.1mol/L=0.5mol/L,向某密闭容器中加入4mol A、1.2mol C和一定量的B三种气体,A的起始浓度为1.0mol/L,体积=![]() =4L,物质的量=0.5mol/L×4L=2mol,故答案为:减小压强; 2mol;
=4L,物质的量=0.5mol/L×4L=2mol,故答案为:减小压强; 2mol;
(3)该反应是体积不变的反应,而t5~t6阶段正逆反应速率都增大,说明是升高了温度;升高温度后正反应速率大于逆反应速率,说明该反应为吸热反应,逆反应为放热反应,故答案为:升高温度,放热反应;
(4)图象分析可知反应速率影响因素可知,升高温度,反应速率增大,Ⅴ的温度最高,故答案为:Ⅴ。


科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.Al2O3用作耐火材料、Al(OH)3用作阻燃剂
B.碳素钢的主要成分是铁碳合金、司母戊鼎的主要成分是铜锡合金
C.自然界中不存在游离态的硅,硅主要以二氧化硅和硅酸盐的形式存在 [
D.通过化学变化可以实现12C与14C间的相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将 0.4mol/L AgNO3 溶液,0.3mol/L MgCl2 溶液和 0.2mol/L 的 AlCl3 溶液按 3:2:1 的体积相混合静置后, 上层清夜中 Cl-的浓度为(混合后溶液体积变化不计)
A. 0.2mol/L B. 0.1mol/L C. 0.6mol/L D. 0.3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.40g碳化硅晶体中含有的C—Si的数目为2NA
B.1L 1 mol·L-1 AlCl3溶液中含有的Al3+数目为NA
C.0.1mol熔融的NaHSO4中含有的阳离子为0.2 NA个
D.在标况下,11.2L HCHO中含有π键的数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列平衡体系中,升温或减压都能使平衡向正反应方向移动的是( )
A. N2(g)+3H2(g)![]() 2NH3(g) ΔH <0
2NH3(g) ΔH <0
B. N2(g)+O2(g)![]() 2NO(g) ΔH <0
2NO(g) ΔH <0
C. C(s)+2H2O(g)![]() CO2(g)+2H2(g) ΔH >0
CO2(g)+2H2(g) ΔH >0
D. 2SO2(g)+O2(g)![]() 2SO3(g) ΔH <0
2SO3(g) ΔH <0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,某容器中各微粒在反应前后变化的示意图如下,其中![]() 和
和![]() 代表不同元素的原子。
代表不同元素的原子。
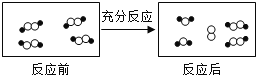
关于此反应说法错误的是( )
A. 一定属于吸热反应 B. 一定属于可逆反应
C. 一定属于氧化还原反应 D. 一定属于分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件下,两瓶气体所含分子数一定相等的是
A.同质量、不同密度的N2和CO B.同温度、同体积的H2和N2
C.同体积、同密度的O3和O2 D.同压强、同体积的N2O和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将1.000mol/L盐酸滴入20.00mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如下图所示。下列有关说法正确的是
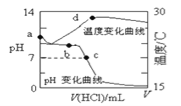
A.a点由水电离出的c(H+)=1.0×10-14mol/L
B.b点时c(NH4+)+c(NH3·H2O)=c(Cl-)
C.c点时消耗的盐酸体积:V(HCl)<20.00mL
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com