
| A. | 利用二氧化碳制造全降解塑料,可以缓解温室效应 | |
| B. | 用电化学方法可在常温常压条件下合成氨,也可以用电解法精炼铜 | |
| C. | 检测NaClO、KMnO4等具有强氧化性物质溶液的PH时,最好选用PH计 | |
| D. | 纤维素经水解、发酵后可制得乙醇和少量甲醇,所得乙醇和甲醇的热值相同 |
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 按系统命名法,化合物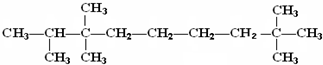 的名称为:2,3,3,8,8-五甲基壬烷 的名称为:2,3,3,8,8-五甲基壬烷 | |
| B. | 将少量溴水加入石油裂化得到的汽油中,溴水分层,上层为橙红色 | |
| C. | 往2ml10%的CuSO4溶液中加入5滴5%的NaOH溶液,再加入2ml10%的葡萄糖溶液,加热,得到砖红色的氧化亚铜沉淀 | |
| D. | 甲烷、乙醇、乙酸在一定条件下都能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
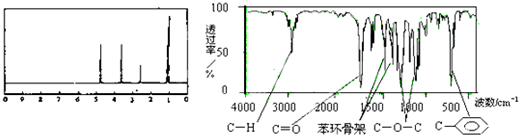
| A. | A分子属于酯类化合物,在一定条件下能发生水解反应 | |
| B. | 符合题中A分子结构特征的有机物有两种 | |
| C. | A在一定条件下可与3 mol H2发生加成反应 | |
| D. | 分子式为C8H8O2且分子中含苯环和-COOR(-R为烃基)的物质共有6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍 | |
| B. | 保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均增加 | |
| C. | 保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍 | |
| D. | 保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F 是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分反应条件略去):
A、B、C、D、E、F 是短周期元素组成的中学常见的物质,它们的转化关系如图所示(部分反应条件略去): .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
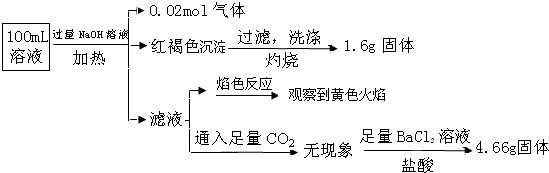
| A. | 原溶液中c(Fe3+)=0.2 mol•L-1 | |
| B. | 溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol•L-1 | |
| C. | SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 | |
| D. | 要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加KSCN溶液,再加入适量氯水,溶液呈血红色,则含有Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 反应物投入量 | 平衡时H2浓度 | 吸收或放出的热量 | 反应物转化率 |
| A | 1、1、0、0 | c1 | Q1 | α1 |
| B | 0、0、2、2 | c2 | Q2 | α2 |
| C | 2、2、0、0 | c3 | Q3 | α3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3═2Na++CO32- | B. | NaHSO4═Na++H++SO42- | ||
| C. | KOH═K++O2-+H+ | D. | H2SO4═2H++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com