
下列关于化合物的说法正确的是
A.只含有共价键的物质一定是共价化合物
B.由两种原子组成的纯净物一定是化合物
C.共价化合物熔化时破坏共价键
D.熔化状态下不导电的化合物一定是共价化合物
科目:高中化学 来源: 题型:
鉴别苯酚溶液、己烷、己烯、乙酸溶液和乙醇5种无色液体,可选用的最佳试剂是
( )
A.溴水、新制的Cu(OH)2
B.FeCl3溶液、金属钠、溴水、石蕊试液
C.石蕊试液、溴水
D.酸性KMnO4溶液、石蕊溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
将铜和锌用导线连接插入硫酸铜溶液中,当导线中有0.2 mol电子通过时,负极质量变化是( )
A.增加6.5 g B.减少6.5 g C.减少5.6 g D.增加5.6 g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于化学键和化合物的说法中正确的是
A.化学键的形成一定伴随着电子的得失
B.金属元素和非金属元素形成的化合物一定是离子化合物
C.非金属元素组成的化合物一定是共价化合物
D.含有阴离子的化合物一定含有阳离子
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的另一种氮的氢化物。
①NH3分子的空间构型是____________;N2H4分子中氮原子轨道的杂化类型是________。
②肼可用作火箭燃料,燃烧时发生的反应是:
N2O4(l)+2N2H4(l)===3N2(g)+4H2O(g)
ΔH=-1 038.7 kJ·mol-1
若该反应中有4 mol N—H键断裂,则形成的π键有____________ mol。
③肼能与硫酸反应生成N2H6SO4。N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4晶体内不存在________(填标号)。
a.离子键 b.共价键
c.配位键 d.范德华力
(2)(2012·新课标全国节选)ⅥA族元素氧、硫、硒(Se)的化合物在研究和生产中有许多重要用途。请回答下列问题:
①H2Se的酸性比H2S________(填“强”或“弱”)。气态SeO3分子的立体构型为____________,SO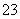 离子的立体构型为____________。
离子的立体构型为____________。
②H2SeO3的K1和K2分别为2.7×10-3和2.5×10-8,H2SeO4第一步几乎完全电离,K2为1.2×10-2,请根据结构与性质的关系解释:
H2SeO4比H2SeO3酸性强的原因:______________________________________
_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
原子序数依次增大的X、Y、Z、W、M五种短周期元素,其中只有Y、Z、W同周期,X、M同主族;Y的单质是天然存在的最硬的物质;Z、W的单质为空气的主要成分。下列各项中正确的是
A.X、M可以形成MX型离子化合物
B.Y、Z、W三种元素的气态氢化物的沸点依次降低
C.M2W2与X2W2的晶体是同种类型的晶体
D.原子半径:M>W>Z>Y>X
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )
| 选项 | 规律 | 结论 |
| A | 较强酸可以制取较弱酸 | 次氯酸溶液无法制取盐酸 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | NH3的沸点低于PH3 |
| D | 溶解度小的沉淀易向溶解度更小的沉淀转化 | ZnS沉淀中滴加CuSO4溶液可以得到CuS沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是________。
a.原子半径和离子半径均减小
b.金属性减弱,非金属性增强
c.氧化物对应的水化物碱性减弱,酸性增强
d.单质的熔点降低
(2)原子最外层电子数与次外层电子数相同的元素名称为________,氧化性最弱的简单阳离子是________。
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
工业制镁时,电解MgCl2而不电解MgO的原因是__________________________________;
制铝时,电解Al2O3而不电解AlCl3的原因是______________________________。
(4)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
Si(粗)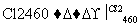 SiCl4
SiCl4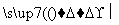 SiCl4(纯)
SiCl4(纯) Si(纯)
Si(纯)
写出SiCl4的电子式:________________;在上述由SiCl4制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:________________________________________________________________________
________________________________________________________________________。
(5)P2O5是非氧化性干燥剂,下列气体不能用浓硫酸干燥,可用P2O5干燥的是________。
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400 ℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知0.1 mol•L-1的醋酸溶液中存在电离平衡:CH3COOH CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
CH3COO-+H+要使溶液中c(H+)/c(CH3COOH)值增大,可以采取的措施是( )
A. 加少量烧碱溶液 B. 加醋酸钠 C. 加少量冰醋酸 D. 加水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com