
【题目】MnO2和Zn是制造普通干电池的重要原料,现用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制备MnO2和Zn的工艺流程如图。下列说法错误的是( )
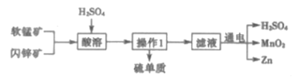
A.干电池是一种将化学能转变为电能的装置
B.原料硫酸可以循环使用,且可用盐酸代替硫酸进行酸溶
C.酸溶时ZnS作还原剂,操作1为过滤
D.通电电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+
【答案】B
【解析】
A. 干电池是一次电池,能将化学能转变为电能,A正确;
B. 盐酸具有还原性,电离产生的Cl-会被MnO2氧化产生有毒气体Cl2,影响Mn2+的电解,因此不能用盐酸代替硫酸使用,B错误;
C. ZnS、MnO2、H2SO4发生氧化还原反应,产生ZnSO4、MnSO4、S及H2O,ZnS作还原剂,反应中S被氧化产生难溶于水的S单质,ZnSO4、MnSO4溶解在水中,所以操作1是分离难溶性固体与可溶性液体混合物的操作,名称为过滤,C正确;
D. 通电时Mn2+在阳极失去电子被氧化产生MnO2,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+,D正确;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】已知铅蓄电池放电时电池反应为PbO2+Pb+4H++![]() =2PbSO4+2H2O。如图是铅蓄电池的工作原理示意图,下列说法正确的是
=2PbSO4+2H2O。如图是铅蓄电池的工作原理示意图,下列说法正确的是
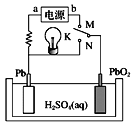
A.K与N连接时,该装置中电能转化为化学能
B.K与N连接时,H+向负极移动
C.K与M连接时,a为电源的负极
D.K与M连接时,阳极附近溶液的pH逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳经济”正成为科学家研究的主要课题。将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g) + 6H2(g) ![]() CH3OCH3(g) + 3H2O(g)
CH3OCH3(g) + 3H2O(g)
(1) 已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2)/n(CO2)]的变化曲线如下图:
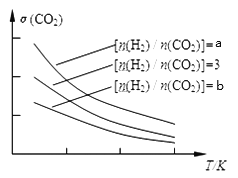
①a、3、b的大小关系___________
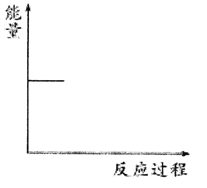
②请根据下图中信息在下图(右)中画出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的能量关系曲线___________。
(2)某温度下,将2.0molCO2(g)和6.0molH2(g)充入容积为2L的密闭容器中,上述反应到达平衡时,改变压强和温度,平衡体系中CH3OCH3(g)的物质的量分数变化情况如图所示,关于温度和压强的关系判断正确的______
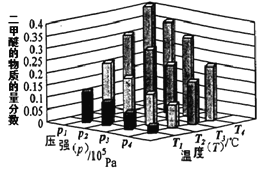
A. P3>P2,T3>T2 B. P1>P3,T1>T3 C. P2>P4,T4>T2 D. P1>P4,T2>T3
(3)在恒容密闭容器里按体积比为1:3充入CO2(g)和H2(g),一定条件下上述反应达到平衡状态。当改变反应的某一个条件后,下列变化能说明平衡一定向逆反应方向移动的是___________
A. 正反应速率先增大后减小 B. 逆反应速率先增大后减小
C. 化学平衡常数K值增大 D. 反应物的浓度增大
(4)下列一定能说明上述反应达到平衡的是___________
A.气体的平均摩尔质量不变
B.恒容条件下,气体的密度不变
C.各物质的速率之比等于系数比
D.[n(H2)/n(CO2)]不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某甲烷燃料电池构造示意图如下,关于该电池的说法不正确的是

A. 电解质溶液中Na+向b极移动
B. b极的电极反应是:O2+2H2O+4e-=4OH-
C. a极是负极,发生氧化反应
D. 电子通过外电路从b电极流向a电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备硝基苯的实验装置如图所示(夹持装置已略去)。下列说法错误的是( )
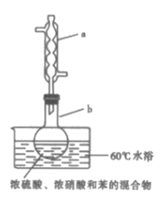
A.水浴加热的优点为使反应物受热均匀、容易控制温度
B.浓硫酸、浓硝酸和苯混合时,应先向浓硝酸中缓缓加入浓硫酸,待冷却至室温后,再将苯逐滴滴入
C.仪器a的作用是冷凝回流,提高原料的利用率
D.可用仪器a、b将反应后的混合物直接蒸馏得到产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理烟气中的SO2,可以采用碱吸-电解法,其流程如图:模拟过程Ⅱ如图,下列推断正确的是( )
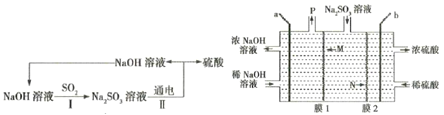
A.膜1为阳离子交换膜,膜2为阴离子交换膜
B.SO2是含有极性键的极性分子
C.a极的电极反应式为2H2O-4e-=4H++O2↑
D.若收集22.4 L的P(标准状况下),则有2 mol N离子移向右室
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25℃和95℃时,其电离平衡曲线如图所示:
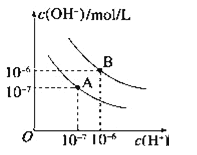
(1)95℃时水的离子积KW=_____.
(2)95℃时,0.01mol/LNaOH溶液的PH=_____.
(3)95℃时水的电离平衡曲线应为___(填“A”或“B”),请说明理由______________________.
(4)25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为______.
(5)95℃时,若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是_________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是_______。
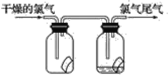
(2)为防止氯气尾气污染空气,实验室通常用________溶液吸收多余的氯气,原理是______________________(用化学方程式表示)。工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是________________(填化学式),漂白粉溶于水后,受空气中的CO2作用,产生有漂白、杀菌作用的次氯酸,化学方程式为_____________________,长期露置于空气中的漂白粉,加稀盐酸后产生的气体是________(填字母,下同)。
A.O2B.Cl2 C.CO2D.HClO
(3)一旦发生氯气泄漏和爆炸事故,周围群众应紧急疏散。当人们逃离爆炸现场时,可以用浸有一定浓度某物质水溶液的毛巾捂住鼻子,最适宜采用的该物质是________。
A.NaOH B.NaCl
C.KCl D.Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:
NaHCO3+H2![]() HCOONa+H2O下列有关说法正确的是
HCOONa+H2O下列有关说法正确的是
A. 储氢、释氢过程均无能量变化
B. NaHCO3、HCOONa均含有离子键和共价键
C. 储氢过程中,NaHCO3被氧化
D. 释氢过程中,每消耗0.1molH2O放出2.24L的H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com