
【题目】已知铅蓄电池放电时电池反应为PbO2+Pb+4H++![]() =2PbSO4+2H2O。如图是铅蓄电池的工作原理示意图,下列说法正确的是
=2PbSO4+2H2O。如图是铅蓄电池的工作原理示意图,下列说法正确的是
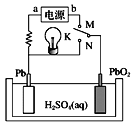
A.K与N连接时,该装置中电能转化为化学能
B.K与N连接时,H+向负极移动
C.K与M连接时,a为电源的负极
D.K与M连接时,阳极附近溶液的pH逐渐增大
 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】根据下图所示的转化关系,回答下列问题:

(1)写出反应①的离子方程式:______________________________________________;写出反应②的离子方程式:______________________。
(2)推出下列物质的化学式:E____________;I______________。
(3)在上述转化过程中,B、C、F、H的氧化能力由弱到强的顺序为______________________(写化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知热化学方程式:
①C2H2(g)+![]() O2(g)
O2(g)![]() 2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
2CO2(g)+H2O(l) ΔH1=-1 301.0 kJ·mol-1
②C(s)+O2(g)![]() CO2(g) ΔH2=-393.5 kJ·mol-1
CO2(g) ΔH2=-393.5 kJ·mol-1
③H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH3=-285.8 kJ·mol-1
H2O(l) ΔH3=-285.8 kJ·mol-1
则反应④2C(s)+H2(g)![]() C2H2(g)的ΔH为( )
C2H2(g)的ΔH为( )
A. -228.2 kJ·mol-1B. +228.2 kJ·mol-1
C. +1301.0 kJ·mol-1D. +621.7 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一绝热(不与外界发生热交换)的恒容容器中,发生反应:2A(g)+B(s) ![]() C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
C(g)+D(g),下列描述中能表明反应已达到平衡状态的有( )个
①容器内温度不变 ②混合气体的密度不变 ③混合气体的压强不变
④混合气体的平均相对分子质量不变 ⑤C(g)的物质的量浓度不变
⑥容器内A、C、D三种气体的浓度之比为2:1:1 ⑦某时刻v(A)=2v(C)且不等于零
⑧单位时间内生成n mol D,同时生成2n mol A
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,写出下列反应的热化学方程式。
(1)在25℃、101kPa下,1g甲醇(CH3OH)燃烧生成CO2和液态水时放热22.68kJ。则表示甲醇燃烧热的热化学方程式为___。
(2)25℃、101kPa若适量的N2和O2完全反应,每生成23gNO2需要吸收16.95kJ热量___。
(3)25℃、101kPa已知拆开1mol H-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391kJ、946kJ,则N2与H2反应生成NH3的热化学方程式为___。
(4)甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂作用下合成甲醇,发生的主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
回答下列问题:
已知反应①中相关的化学键键能数据如下:
化学键 | H—H | C—O | C | H—O | C—H |
E/(kJ·mol-1) | 436 | 343 | 1076 | 465 | 413 |
由此计算△H1=___kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3=___kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的原料都是来源于石油化工,回答下列问题。
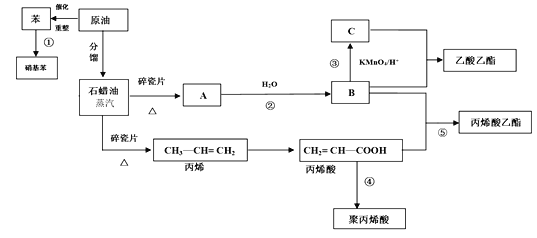
(1)丙烯酸中的官能团的名称为_______。
(2)反应①的化学方程式_______;反应⑤的化学方程式_______。
(3)丙烯酸(CH2 = CH—COOH)可能发生的反应有_______(填序号)
A.加成反应 B.取代反应 C.加聚反应 D.中和反应 E.氧化反应
(4)聚丙烯酸的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米Fe3O4在磁流体、催化剂、医学等领域具有广阔的应用前景。氧化共沉淀制备纳米Fe3O4的方法如下:
I.Fe2+的氧化:将FeSO4溶液用NaOH溶液调节pH至a,再加入H2O2溶液,立即得到 FeO( OH)红棕色悬浊液。
(1)①若用NaOH溶液调节pH过高会产生灰白色沉淀,该反应的离子方程式是 _____________。
②上述反应完成后,测得a值与FeO(OH)产率及其生成后溶液pH的关系,结果如下:
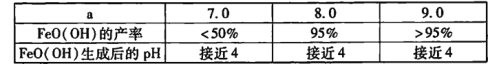
用离子方程式解释FeO( OH)生成后溶液pH下降的原因:____。
(2)经检验:当a=7时,产物中存在大量Fe2O3。对Fe2 O3的产生提出两种假设:
i.反应过程中溶液酸性增强,导致FeO( OH)向Fe2 O3的转化;
ii.溶液中存在少量Fe2+,导致FeO( OH)向Fe2O3的转化。
①经分析,假设i不成立的实验依据是____。
②其他条件相同时,向FeO( OH)浊液中加入不同浓度Fe2+,30 min后测定物质的组成,结果如下:
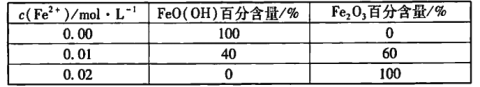
以上结果表明:____。
③ a=7和a =9时,FeO( OH)产率差异很大的原因是____。
Ⅱ.Fe2+和Fe3+共沉淀:向FeO( OH)红棕色悬浊液中同时加入FeSO4溶液和NaOH浓溶液进行共沉淀,再将此混合液加热回流、冷却、过滤、洗涤、干燥,得到纳米Fe3O4。
(3)共沉淀时的反应条件对产物纯度和产率的影响极大。
①共沉淀pH过高时,会导致FeSO4溶液被快速氧化;共沉淀pH过低时,得到的纳米Fe3O4中会混有的物质是____。
②已知N=n[FeO(OH)]/n(Fe2+),其他条件一定时,测得纳米Fe3O4的产率随N的变化曲线如下图所示:

经理论分析,N=2共沉淀时纳米Fe3O4产率应最高,事实并非如此的可能原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组同学猜想自来水中可能含有大量Ca2+、Mg2+和某些阴离子,从而进行了三组实验:
①取适量自来水于试管中,滴加足量的NaOH溶液,产生白色沉淀;
②过滤后取滤液于试管中,滴加足量的Na2CO3溶液,又有白色沉淀生成;
③另取适量自来水于试管中,滴加足量稀硝酸后再滴加AgNO3溶液,也产生白色沉淀。
请回答以下问题:
(1) 通过实验可初步确定自来水中________(填“含有”或“不含有”)大量Ca2+、Mg2+。
(2) 自来水中所含阴离子可以确定有___________,该离子遇AgNO3溶液发生反应的离子方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnO2和Zn是制造普通干电池的重要原料,现用软锰矿(主要成分为MnO2)和闪锌矿(主要成分为ZnS)制备MnO2和Zn的工艺流程如图。下列说法错误的是( )
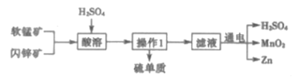
A.干电池是一种将化学能转变为电能的装置
B.原料硫酸可以循环使用,且可用盐酸代替硫酸进行酸溶
C.酸溶时ZnS作还原剂,操作1为过滤
D.通电电解时MnO2在阳极处生成,电极反应为:Mn2+-2e-+2H2O=MnO2+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com