
【题目】工业中很多重要的原料都是来源于石油化工,回答下列问题。
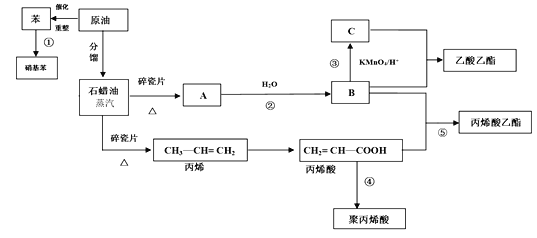
(1)丙烯酸中的官能团的名称为_______。
(2)反应①的化学方程式_______;反应⑤的化学方程式_______。
(3)丙烯酸(CH2 = CH—COOH)可能发生的反应有_______(填序号)
A.加成反应 B.取代反应 C.加聚反应 D.中和反应 E.氧化反应
(4)聚丙烯酸的结构简式为______________。
【答案】碳碳双键、羧基 ![]() CH2=CH-COOH+C2H5OH
CH2=CH-COOH+C2H5OH![]() CH2=CH-COOC2H5+H2O ABCDE
CH2=CH-COOC2H5+H2O ABCDE 
【解析】
分析流程图可知,A为乙烯,B为乙醇,C为乙酸。
(1)丙烯酸的结构简式为CH2=CH-COOH,它含有碳碳双键和羧基两种官能团。
答案为:碳碳双键、羧基;
(2)反应①为苯与混酸制硝基苯的反应,其反应的化学方程式为:
![]() ,反应⑤的化学方程式:CH2=CH-COOH+C2H5OH
,反应⑤的化学方程式:CH2=CH-COOH+C2H5OH![]() CH2=CH-COOC2H5+H2O,
CH2=CH-COOC2H5+H2O,
答案为:![]() ;CH2=CH-COOH+C2H5OH
;CH2=CH-COOH+C2H5OH![]() CH2=CH-COOC2H5+H2O;
CH2=CH-COOC2H5+H2O;
(3)丙烯酸(CH2 = CH—COOH)中含有碳碳双键和羧基,碳碳双键能发生加成反应、加聚反应、氧化反应,羧基能发生取代反应、中和反应,
答案为:ABCDE;
(4)聚丙烯酸的结构简式为 , 答案为
, 答案为 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有金属单质A、B和气体甲、乙、丙及物质C、D、E、F、G,它们之间能发生如图反应(图中有些反应的产物和反应的条件没有全部标出)。

请根据以上信息回答下列问题:
(1)写出下列物质的化学式:乙_________,F__________。
(2)写出下列反应的离子方程式:
①金属A和水反应_______________。②红褐色沉淀C与物质E反应__________。
③F与黄绿色气体乙反应____________。
④实验室常用氢氧化钠吸收实验过程中的黄绿色气体乙,写出用氢氧化钠溶液吸收该气体的离子方程式___。
(3)将G溶液逐滴加入到沸水中会产生一种红褐色的液体。你认为该液体中的分散质粒子直径在______之间,验证的简单方法是:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应![]() 在一容积可变的密闭容器中进行,试回答:
在一容积可变的密闭容器中进行,试回答:
(1)增加Fe的量,其反应速率__________(填“增大”“不变”或“减小”,下同)。
(2)将容器的体积缩小一半,其反应速率__________。
(3)保持体积不变,充入![]() 使体系压强增大,其反应速率__________。
使体系压强增大,其反应速率__________。
(4)保持压强不变,充入![]() 使容器的体积增大,其反应速率__________。
使容器的体积增大,其反应速率__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视.目前工业上有一种方法是用CO2来生产燃料甲醇.为探究该反应原理,进行如下实验:在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生发应,CO2(g)+3H2(g)CH3OH(g)+H2O(g)。实验测得CO2和CH3OH(g)的物质的量(n)随时间变化如下图1所示:
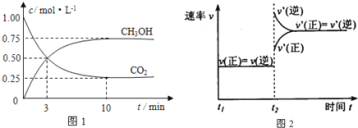
(1)从反应开始到平衡,氢气的平均反应速率υ(H2)=___。500℃达平衡时,CH3OH(g)的体积分数为___,图2是改变温度时化学反应速率随时间变化的示意图,则该反应的正反应为___反应(填“放热”或“吸热”)。
(2)下列措施中不能使CO2的转化率增大的是___。
A.在原容器中再充入1molH2 B.在原容器中再充入1molCO2
C.缩小容器的容积 D.使用更有效的催化剂
E.将水蒸气从体系中分离出
(3)下列措施能使n(CH3OH)/n(CO2)增大的是___。
A.升高温度 B.恒容充入1molHe
C.将水蒸气从体系中分离出 D.缩小容器容积,增大压强
E.恒压充入1molHe
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铅蓄电池放电时电池反应为PbO2+Pb+4H++![]() =2PbSO4+2H2O。如图是铅蓄电池的工作原理示意图,下列说法正确的是
=2PbSO4+2H2O。如图是铅蓄电池的工作原理示意图,下列说法正确的是
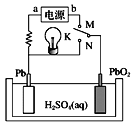
A.K与N连接时,该装置中电能转化为化学能
B.K与N连接时,H+向负极移动
C.K与M连接时,a为电源的负极
D.K与M连接时,阳极附近溶液的pH逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硫的含量影响钢铁性能.碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定.
(1)采用如图装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2.
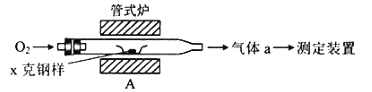
①气体a的成分是_____.
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2![]() 1_____+3_____.
1_____+3_____.
(2)将气体a通入测硫酸装置中(如图),采用滴定法测定硫的含量.
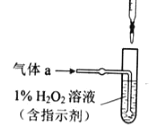
①H2O2氧化SO2的化学方程式:_____
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液.若消耗1mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:_____.
(3)将气体a通入测碳装置中(如图),采用重量法测定碳的含量.
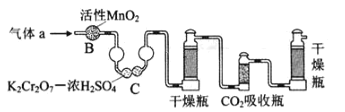
①气体a通过B和C的目的是_____
②计算钢样中碳的质量分数,应测量的数据是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硝酸厂处理尾气中NO的方法是在催化剂存在下,用H2将NO还原为N2,其热化学方程式为NO(g)+H2(g)=![]() N2(g)+H2O(g) ΔH=mkJ·mol-1,其能量变化过程如图:
N2(g)+H2O(g) ΔH=mkJ·mol-1,其能量变化过程如图:
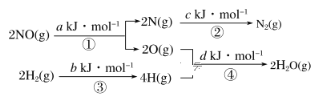
下列说法正确的是( )
A.过程①、②、③、④都是放热过程B.m=+![]() (a+b-c-d)kJ·mol-1
(a+b-c-d)kJ·mol-1
C.m=-![]() (c+a-d-b)kJ·mol-1D.m=+
(c+a-d-b)kJ·mol-1D.m=+![]() (c+d-a-b) kJ·mol-1
(c+d-a-b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由一种阳离子与两种酸根阴离子组成的盐称为混盐。向混盐Na4S2O3中加入足量稀硫酸,发生反应:![]() 。下列说法正确的是( )
。下列说法正确的是( )
A. Na4S2O3的水溶液显碱性
B.1mol Na4S2O3中共含离子数为5NA
C.上述反应中,每产生3molS,转移电子的物质的量为6mol
D.CaOCl2也可称为混盐,向CaOCl2中加入足量稀硫酸会有Cl2产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】处理烟气中的SO2,可以采用碱吸-电解法,其流程如图:模拟过程Ⅱ如图,下列推断正确的是( )
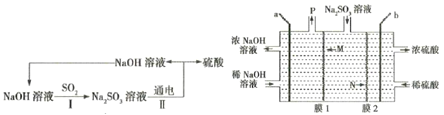
A.膜1为阳离子交换膜,膜2为阴离子交换膜
B.SO2是含有极性键的极性分子
C.a极的电极反应式为2H2O-4e-=4H++O2↑
D.若收集22.4 L的P(标准状况下),则有2 mol N离子移向右室
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com