
【题目】碳、硫的含量影响钢铁性能.碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定.
(1)采用如图装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2.
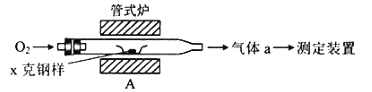
①气体a的成分是_____.
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2![]() 1_____+3_____.
1_____+3_____.
(2)将气体a通入测硫酸装置中(如图),采用滴定法测定硫的含量.
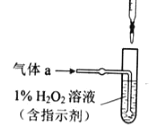
①H2O2氧化SO2的化学方程式:_____
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液.若消耗1mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:_____.
(3)将气体a通入测碳装置中(如图),采用重量法测定碳的含量.
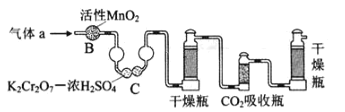
①气体a通过B和C的目的是_____
②计算钢样中碳的质量分数,应测量的数据是_____.
【答案】CO2、SO2、O2 Fe3O4 SO2 H2O2+SO2=H2SO4 ![]() 除去SO2对CO2测定的干扰 吸收CO2气体前后吸收瓶的质量
除去SO2对CO2测定的干扰 吸收CO2气体前后吸收瓶的质量
【解析】
(1)①该装置中C、S和氧气反应生成二氧化碳、二氧化硫,还有部分氧气剩余;
②若钢样中S以FeS形式存在,FeS被氧气氧化,Fe元素化合价由+2价变为+3价,-2价的S被氧化为+4价,结合化学计量数知,生成物是二氧化硫和四氧化三铁;
(2)①双氧水具有强氧化性,二氧化硫具有还原性,二者发生氧化还原反应生成硫酸;
②若消耗1mL NaOH溶液相当于硫的质量为y克,z mL NaOH溶液相当于硫的质量为yzg,再根据质量分数公式计算硫的质量分数;
(3)①测定二氧化碳的含量,需要将二氧化硫除去防止造成干扰;
②计算钢样中碳的质量分数,需要测定吸收二氧化碳的质量。
(1)①钢样中的碳、硫在装置A中被氧化为CO2、SO2,故a的成分为CO2、SO2以及未反应的O2;
②FeS中的-2价的硫被氧化为SO2,+2价的Fe被氧化为+3价的铁,结合所给化学计量数,可知产物应为Fe3O4和SO2,故方程式为3FeS+5O2![]() Fe3O4+3SO2;
Fe3O4+3SO2;
(2)①H2O2具有氧化性,可氧化SO2使S的化合价升高为+6价,在溶液中反应产物应为硫酸,故反应方程式为:H2O2+SO2=H2SO4;
②1mL NaOH相当于yg S,故z mL NaOH相当于zy g S,则该样品中硫的质量分数为![]() ;
;
(3)①测定碳的含量需将气体a中的SO2除去,防止造成干扰,B装置可氧化二氧化硫,C装置可以吸收二氧化硫,所以装置B和C的作用是氧化二氧化硫、除去二氧化硫,故装置B和C的作用是除去SO2;
②计算碳的质量分数须利用CO2的质量进行分析,故需测量CO2吸收瓶在吸收CO2气体前后的质量。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在0.2 L由NaCl溶液、MgCl2溶液、CuCl2溶液组成的混合溶液中,部分离子的浓度如图所示。
(1)混合液中,NaCl的物质的量为_______mol,MgCl2的质量为_______g。
(2)该混合溶液中CuCl2的物质的量浓度为_____molL﹣1,将该混合溶液加水稀释至体积为1 L,稀释后溶液中Cu2+的物质的量浓度为_______molL﹣1。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2SO2(g)+ O2(g)![]() 2SO3(g)能量变化如右图所示。 已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
2SO3(g)能量变化如右图所示。 已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
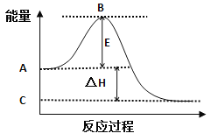
(1)E的大小对该反应的△H _______(填“有” 或“无”)影响。该反应常用V2O5作催化剂,加入V2O5会使图中B点_________(填“升高”、“降低”或“不变”),原因是____________________。
(2)V2O5 的催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒化合物,四价钒化合物再被氧气氧化。写出该催化循环机理的两个化学方程式:______、_______。
(3)已知单质硫的标准燃烧热为296kJ·mol-1,则常温常压下,由单质硫和氧气经两步反应,若生成3mol SO3(g),放出的总热量为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。
(1)溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,写出CO2溶于水产生HCO3-的方程式: 。
(2)在海洋循环中,通过下图所示的途径固碳。

①写出钙化作用的离子方程式: 。
②同位素示踪法证实光合作用释放出的O2只来自于H2O,用18O标记物质的光合作用的化学方程式如下,将其补充完整: + ===(CH2O)x+x18O2+xH2O
(3)海水中溶解无机碳占海水总碳的95%以上,其准确测量是研究海洋碳循环的基础,测量溶解无机碳,可采用如下方法:
①气提、吸收CO2,用N2从酸化后的还说中吹出CO2并用碱液吸收(装置示意图如下),将虚线框中的装置补充完整并标出所用试剂。

②滴定。将吸收液洗后的无机碳转化为NaHCO3,再用xmol/LHCl溶液滴定,消耗ymlHCl溶液,海水中溶解无机碳的浓度= mol/L。
(4)利用下图所示装置从海水中提取CO2,有利于减少环境温室气体含量。

①结合方程式简述提取CO2的原理: 。
②用该装置产生的物质处理b室排出的海水,合格后排回大海。处理至合格的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业中很多重要的原料都是来源于石油化工,回答下列问题。
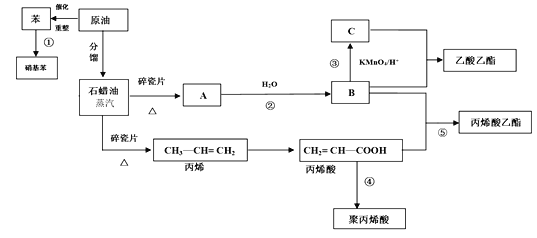
(1)丙烯酸中的官能团的名称为_______。
(2)反应①的化学方程式_______;反应⑤的化学方程式_______。
(3)丙烯酸(CH2 = CH—COOH)可能发生的反应有_______(填序号)
A.加成反应 B.取代反应 C.加聚反应 D.中和反应 E.氧化反应
(4)聚丙烯酸的结构简式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着现代工业的快速发展,SO2烟气的排放量急剧增加。将SO2还原为硫磺是目前烟气脱硫研究的热点。根据SO2的反应状态,将SO2还原法分为气相还原法和液相还原法。
Ⅰ.气相还原法—固体还原剂直接还原法
固体还原剂直接还原法是指在一定温度下(200℃~300℃)将SO2烟气通过固体还原剂,使SO2中的氧原子转移到固体还原剂上,从而实现SO2的还原,其流程如下:
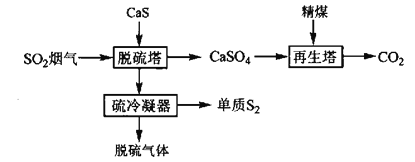
(1)再生塔中生成的物质______(填化学式)可在流程中循环使用。
(2)脱硫塔中发生反应的化学方程式为________。脱硫过程中,当产生48g单质S2时,转移电子的物质的量为______mol。
Ⅱ.液相还原法—液相催化歧化制硫法
V.M Petrusevski等人用![]() 作为催化剂,在常温下,将NaHSO3进行液相催化回收硫磺的工艺如下:
作为催化剂,在常温下,将NaHSO3进行液相催化回收硫磺的工艺如下:
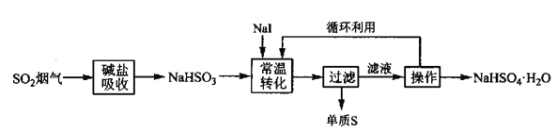
(3)下列仪器中,“操作”时不需要用到的是______(填标号)。
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
(4)![]() 催化NaHSO3的反应过程为①_________(用离子方程式表示);②
催化NaHSO3的反应过程为①_________(用离子方程式表示);②![]() 。
。
(5)液相催化歧化制硫法具有反应条件温和、运行费用低等优点,然而其缺点是硫磺的回收率不会高于______%(保留1位小数)。
(6)若采用Na2S溶液作为碱盐吸收液,随着吸收液pH的变化,会生成二次污染物______(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,K、L、M均是由这些元素组成的氧化物,甲、乙分别是元素Y、W的单质,甲是常见的固体,乙是常见的气体。K是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。下列说法错误的是( )
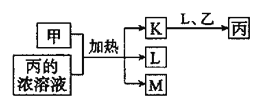
A.X、Y、Z三种元素的第一电离能:![]()
B.X分别与Y、Z、W形成的分子中均可能含有非极性共价键
C.Z元素的最高价含氧酸的酸性在同周期和同主族元素中均最强
D.若固体![]() 是由直线形的
是由直线形的![]() 和平面三角形的
和平面三角形的![]() 组成,则
组成,则![]() 与丙溶液中的溶质阴离子相同
与丙溶液中的溶质阴离子相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Pd-Mg/SiO2催化剂上CO2甲烷化反应机理如图所示。下列说法错误的是( )
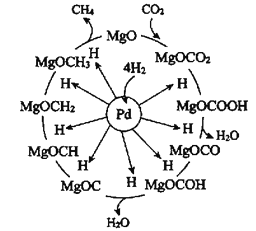
A.上述甲烷化过程总反应可表示为CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
B.整个甲烷化过程真正起催化作用的物质为MgO
C.Pd-Mg/SiO2催化剂加快了甲烷化速率,提高了H2的平衡转化率
D.经过一个加氢循环后的MgO再次与CO2结合形成碳酸盐,继续一个新的加氢循环过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在20 mL0.1 mol·L-1一元弱酸HA溶液中滴加0.1 mol·L-1NaOH溶液,溶液中lg![]() 与pH关系如图所示。下列说法正确的是( )
与pH关系如图所示。下列说法正确的是( )
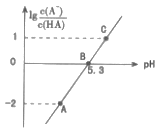
A.25℃时,HA酸的电离常数为1.0×10-5.3
B.A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
C.B点对应的NaOH溶液体积为10 mL
D.对C点溶液加热(不考虑挥发),则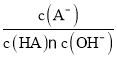 一定减小
一定减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com