
【题目】随着现代工业的快速发展,SO2烟气的排放量急剧增加。将SO2还原为硫磺是目前烟气脱硫研究的热点。根据SO2的反应状态,将SO2还原法分为气相还原法和液相还原法。
Ⅰ.气相还原法—固体还原剂直接还原法
固体还原剂直接还原法是指在一定温度下(200℃~300℃)将SO2烟气通过固体还原剂,使SO2中的氧原子转移到固体还原剂上,从而实现SO2的还原,其流程如下:
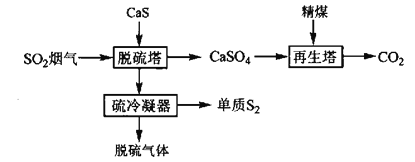
(1)再生塔中生成的物质______(填化学式)可在流程中循环使用。
(2)脱硫塔中发生反应的化学方程式为________。脱硫过程中,当产生48g单质S2时,转移电子的物质的量为______mol。
Ⅱ.液相还原法—液相催化歧化制硫法
V.M Petrusevski等人用![]() 作为催化剂,在常温下,将NaHSO3进行液相催化回收硫磺的工艺如下:
作为催化剂,在常温下,将NaHSO3进行液相催化回收硫磺的工艺如下:
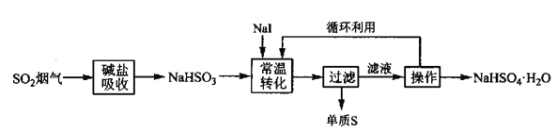
(3)下列仪器中,“操作”时不需要用到的是______(填标号)。
a.![]() b.
b.![]() c.
c.![]() d.
d.![]()
(4)![]() 催化NaHSO3的反应过程为①_________(用离子方程式表示);②
催化NaHSO3的反应过程为①_________(用离子方程式表示);②![]() 。
。
(5)液相催化歧化制硫法具有反应条件温和、运行费用低等优点,然而其缺点是硫磺的回收率不会高于______%(保留1位小数)。
(6)若采用Na2S溶液作为碱盐吸收液,随着吸收液pH的变化,会生成二次污染物______(填化学式)。
【答案】CaS CaS+2SO2![]() CaSO4+S2 3 a
CaSO4+S2 3 a ![]() 33.3 H2S
33.3 H2S
【解析】
Ⅰ.气相还原法—固体还原剂直接还原法
根据流程,在脱硫塔中CaS与SO2反应生成CaSO4和S2,在再生塔中精煤与CaSO4反应生成CO2和CaS,CaS循环使用,据此分析、结合相关知识作答。
Ⅱ.液相还原法—液相催化歧化制硫法
SO2烟气用碱盐吸收转化成NaHSO3,根据流程,加入NaI催化NaHSO3反应生成S和NaHSO4,总反应为![]() ,据此分析、结合相关知识作答。
,据此分析、结合相关知识作答。
Ⅰ.气相还原法—固体还原剂直接还原法
(1)根据流程,在再生塔中精煤与CaSO4反应生成CO2,C被氧化成CO2,则CaSO4被还原成CaS而在流程中循环使用,反应可表示为2C+CaSO4=CaS+2CO2↑,故答案为:CaS;
(2)根据“固体还原剂直接还原法是指在一定温度下(200℃~300℃)将SO2烟气通过固体还原剂,使SO2中的氧原子转移到固体还原剂上,从而实现SO2的还原”和流程,在脱硫塔中CaS与SO2反应生成CaSO4和S2,根据原子守恒,脱硫塔中发生反应的化学方程式为CaS+2SO2![]() CaSO4+S2;在该反应中,CaS中S元素的化合价由-2价升至0价,SO2中S元素的化合价部分由+4价升至+6价、部分由+4价降至0价,生成1molS2转移4mol电子,当产生48g单质S2时转移电子物质的量为
CaSO4+S2;在该反应中,CaS中S元素的化合价由-2价升至0价,SO2中S元素的化合价部分由+4价升至+6价、部分由+4价降至0价,生成1molS2转移4mol电子,当产生48g单质S2时转移电子物质的量为![]() ×4=3mol,故答案为:CaS+2SO2
×4=3mol,故答案为:CaS+2SO2![]() CaSO4+S2,3。
CaSO4+S2,3。
Ⅱ.液相还原法—液相催化歧化制硫法
(3)根据流程,“操作”是从含NaHSO4的溶液中获得NaHSO4·H2O,故“操作”为蒸发浓缩、冷却结晶、过滤、洗涤,蒸发浓缩时需要使用蒸发皿和坩埚钳,过滤时需要使用漏斗,则“操作”时不需要用到的是坩埚,答案选a;
(4)②的反应为![]() ,在②中I2将
,在②中I2将![]() 氧化成
氧化成![]() ,I2被还原成I-,根据流程I-催化NaHSO3反应生成S和NaHSO4,I-是催化剂,在反应前后质量和化学性质不变,则①中I-将NaHSO3还原成S,I-被氧化成I2,根据得失电子守恒、原子守恒、电荷守恒,①的离子方程式为
,I2被还原成I-,根据流程I-催化NaHSO3反应生成S和NaHSO4,I-是催化剂,在反应前后质量和化学性质不变,则①中I-将NaHSO3还原成S,I-被氧化成I2,根据得失电子守恒、原子守恒、电荷守恒,①的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
(5)根据(4)的分析,液相催化歧化制硫法的总反应为![]() ,理论上3mol
,理论上3mol![]() 反应生成1molS,所以该法硫磺的回收率不会超过
反应生成1molS,所以该法硫磺的回收率不会超过![]() ,即不会高于33.3%,故答案为33.3;
,即不会高于33.3%,故答案为33.3;
(6)若采用Na2S溶液作为碱盐吸收液,由于H2SO3的酸性强于H2S,SO2与Na2S溶液反应会生成H2S产生二次污染,故答案为H2S。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】Pd/A12O3是常见的汽车尾气催化剂。一种从废Pd/A12O3纳米催化剂(主要成分及含量:Pd0.3%,γ-A12O392.8%,其他杂质6.0%)中回收金属Pd的工艺:
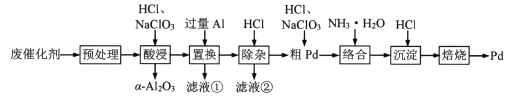
已知:γ-Al2O3能与酸反应,α-A12O3不与酸反应。
回答下列问题:
(1)“预处理”时,γ-A12O3经焙烧转化为α-A12O3,该操作的主要目的是_________。
(2)“酸浸”时,Pd转化为PdCl42-,其离子方程式为_________。
(3)“滤液①”和“滤液②”中都含有的主要溶质有_________(填化学式)。
(4)“粗Pd”溶解时,可用稀HNO3替代NaClO3,但缺点是_________。两者相比,_________(填化学式)的氧化效率更高(氧化效率以单位质量得到的电子数表示)。
(5)“沉淀”时,[Pd(NH3)4]2+转化为[Pd(NH3)2]Cl2沉淀,其化学方程式为_________。
(6)酸性条件下,BrO3-能在负载Pd/A12O3纳米催化剂的电极表面快速转化为Br-。
①发生上述转化反应的电极应接电源的_________极(填“正”或“负”);
②研究表明,电流密度越大,电催化效率越高;但当电流密度过大时,该电极会发生副反应生成_________填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )

①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→Zn
⑥正极反应式:Cu+2e-=Cu2+,发生氧化反应
A. ①②③B. ②④⑥
C. ②④D. ③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取乙酸乙酯的装置如下图,按要求回答问题。
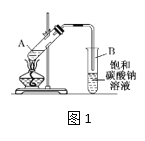
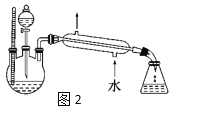
(1)写出制取乙酸乙酯的化学方程式_________________________。
(2)浓硫酸的作用是______,长导管末端不伸入饱和碳酸钠溶液的目的是______。
(3)上述实验中饱和碳酸钠溶液的作用是_______(填字母代号)。
A.反应掉乙酸和乙醇
B.反应掉乙酸并吸收部分乙醇
C.乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中的更小,有利于分层析出
(4)某化学课外小组设计了图2所示的制取乙酸乙酯的装置(铁架台、铁夹、加热装置均已略去),与图1装置相比,此装置的主要优点有______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硫的含量影响钢铁性能.碳、硫含量的一种测定方法是将钢样中碳、硫转化为气体,再用测碳、测硫装置进行测定.
(1)采用如图装置A,在高温下将x克钢样中碳、硫转化为CO2、SO2.
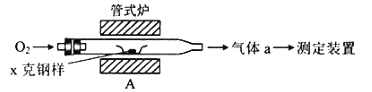
①气体a的成分是_____.
②若钢样中硫以FeS形式存在,A中反应:3FeS+5O2![]() 1_____+3_____.
1_____+3_____.
(2)将气体a通入测硫酸装置中(如图),采用滴定法测定硫的含量.
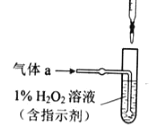
①H2O2氧化SO2的化学方程式:_____
②用NaOH溶液滴定生成的H2SO4,消耗z mL NaOH溶液.若消耗1mL NaOH溶液相当于硫的质量为y克,则该钢样中硫的质量分数:_____.
(3)将气体a通入测碳装置中(如图),采用重量法测定碳的含量.
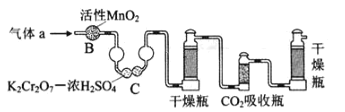
①气体a通过B和C的目的是_____
②计算钢样中碳的质量分数,应测量的数据是_____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为1 L的密闭容器中,加入5 mol A物质,在一定条件下同时发生下列两个反应:①2A(g)![]() 2B(g)+C(g);②A(g)
2B(g)+C(g);②A(g)![]() C(g)+D(g),当达到平衡时,测得c(A)= 2.5 mol/L,c(C)=2.0 mol/L.,则下列说法中正确的是
C(g)+D(g),当达到平衡时,测得c(A)= 2.5 mol/L,c(C)=2.0 mol/L.,则下列说法中正确的是
A.达到平衡时A的总转化率为40%
B.达到平衡时c(B)为1.0 mol/L
C.达到平衡时c(B)=2c(D)
D.达到平衡时c(D)=2c(B)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于酸碱中和滴定实验的说法正确的是( )
A.用图B的滴定管可准确量取25.00mL的酸性KMnO4溶液
B.滴定过程中,眼睛要时刻注视滴定管中液面的变化
C.滴定管装入液体前需用待装液润洗
D.滴定前平视,滴定结束后仰视读数,不影响测定结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】查阅资料:元素铬(Cr)在溶液中主要以Cr3+(蓝紫色) 、Cr(OH)4-(绿色) 、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)铬(24Cr)属于________(选填编号)。
a.主族元素 b.副族元素 c.Ⅶ族元素 d.过渡元素
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol·L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
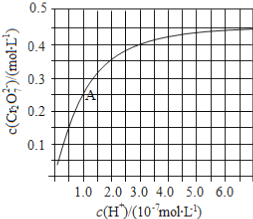
①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH_________0(填“>”“<”或“=”)。
(3)欲降低废水中重金属元素铬的毒性,可将Cr2O72-转化为Cr(OH)3沉淀除去.已知:
氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
Fe2+ | 7.0 | 9.0 |
Fe3+ | 1.9 | 3.2 |
Cr3+ | 6.0 | 8.0 |
某含铬废水处理的主要流程如图所示:
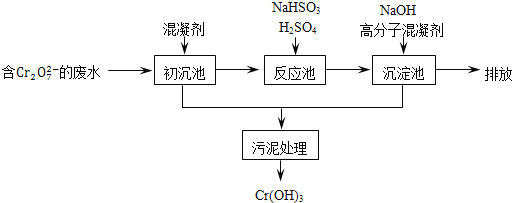
①初沉池中加入的混凝剂是K2SO4﹒Al2(SO4)3﹒24H2O,其作用为__________(用离子方程式表示).
②反应池中用NaHSO3将酸性废液中的Cr2O72-还原成Cr3+,该反应的离子方程式为________.根据“沉淀法”和“中和法”的原理,向沉淀池中加入NaOH溶液,此过程中发生主要反应的离子的先后顺序是____________.证明Cr3+沉淀完全的方法是__________.
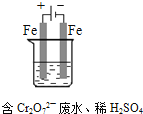
(4)工业可用电解法来处理含 Cr2O72-废水.实验室利用如图模拟处理含Cr2O72-的废水,阳极反应式是Fe-2e-═Fe2+,阴极反应式是2H++2e-═H2↑.Fe2+与酸性溶液中的Cr2O72-反应的离子方程式是__________,得到的金属阳离子在阴极区可沉淀完全,用电解法处理该溶液中0.01mol Cr2O72-时,至少得到沉淀的质量是__________ g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有常温下pH=2的盐酸甲和pH=2的醋酸溶液乙,请根据下列操作回答问题:
(1)常温下0.lmol/L的CH3COOH溶液加水稀释过程,下列表达式的数据一定增大的是__________
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-) D.c(OH-)/c(H+)
(2)取10mL乙溶液,加入等体积水,醋酸的电离平衡___________(填“向左”、“向右”或“不”)移动;另取10mL的乙溶液,加入少量无水醋酸钠固体 (假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中c(H+)/c(CH3COOH)的比值将___________(填“增大”“ 减小”或“无法确定”)。
(3)取等体积的甲、乙两溶液,分别用等浓度的NaOH稀溶液中和,则消耗的NaOH溶液的体积大小关系为:V(甲)___________V(乙) (填“>”、“ <”或“=”)。
(4)已知25℃时,两种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数K1 | 1.8×l1-5 | 4.3×l0-7 | 3.0×10-8 |
K2 | - - | 5.6×10-11 | - - |
下列四种离子结合H+能力最强的是___________;
A.HCO3- B.CO32- C.ClO- D.CH3COO-
(5)常温下,取甲溶液稀释100倍,其pH=___________;取99mL甲溶液与lrnLlmol/L的NaOH溶液混合(忽略溶液体积变化),恢复至常温时其pH=______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com