
【题目】化合物a、b的结构简式如图所示,下列说法正确的是

A. 化合物b不能使酸性高锰酸钾溶液褪色 B. a的消去产物中最多有15个碳原子共面
C. a、b均能发生还原反应、取代反应、消去反应 D. b分子发生加成反应最多消耗4mol H2
科目:高中化学 来源: 题型:
【题目】亚氯酸钠是一种高效氧化剂、漂白剂,主要用于棉纺、亚麻、纸浆等漂白。亚氯酸钠(NaClO2)在溶液中可生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都具有漂白作用,但ClO2是有毒气体。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则下列分析不正确的是( )

A.亚氯酸钠在碱性条件下较稳定
B.25℃时,HClO2的电离平衡常数的数值Ka=10-6
C.使用该漂白剂的最佳pH为3
D.25℃时,同浓度的HClO2溶液和NaClO2溶液等体积混合,混合溶液中有c(HClO2)+2c(H+)=c(ClO2-)+2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中,两种气体的分子数一定相等的是 ( )
A. 温度相同、体积相同的O2和N2 B. 体积相等、密度不等的CO和C2H4
C. 质量相等、密度不等的CO和C2H4 D. 压强相同、体积相同的O2和N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(主要成分为CuFeS2)是生产铜、铁和硫酸的原料。回答下列问题:
(1)基态Cu原子的价电子排布式为________
(2)从原子结构角度分析,第一电离能I1(Fe)与I1(Cu)的关系是:I1(Fe)____I1(Cu)(填“>“<"或“=”)
(3)血红素是吡咯(C4H5N)的重要衍生物,血红素(含Fe2+)可用于治疗缺铁性贫血。吡略和血红素的结构如下图:
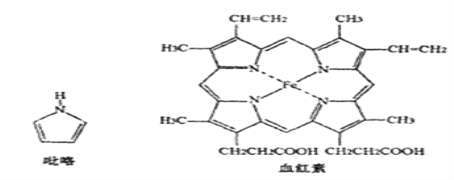
①已知吡咯中的各个原子均在同一平面内,则吡咯分子中N原子的杂化类型为_______
②1mol吡咯分子中所含的σ键总数为____个。分子中的大π键可用![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡略环中的大π键应表示为_____。
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数,则吡略环中的大π键应表示为_____。
③C、N、O三种元素的简单氢化物中,沸点由低到高的顺序为________(填化学式)。
④血液中的O2是由血红素在人体内形成的血红蛋白来输送的,则血红蛋白中的Fe2+与O2是通过_____键相结合。
(4)黄铜矿冶炼铜时产生的SO2可经过SO2![]() SO3
SO3![]() H2SO4途径形成酸雨。SO2的空间构 型为________。H2SO4的酸性强于H2SO3的原因是____________
H2SO4途径形成酸雨。SO2的空间构 型为________。H2SO4的酸性强于H2SO3的原因是____________
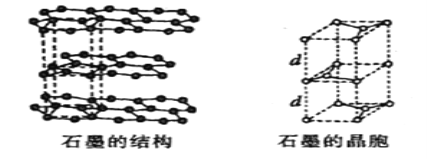
(5)用石墨作电极处理黄铜矿可制得硫酸铜溶液和单质硫。石墨的晶体结构如下图所示,虚线勾勒出的是其晶胞。则石墨晶胞中含碳原子数为____个。已知石墨的密度为ρg/cm3,C-C键的键长为rcm,设阿伏加德罗常数的值为NA,则石墨晶体的层间距d=______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2 mol·L-1H2A溶液中滴加0.2 mol·L-1NaOH溶液。有关微粒的物质的量变化如图所示(其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-),根据图示判断,下列说法正确的是

A. 当V( NaOH )= 20mL时,pH<7
B. 当V(NaOH)= 20mL时,溶液中离子浓度大小关系为c(Na+)>c(A2-)>c(OH-)>c(HA-)>c(H+)
C. 当V(NaOH)= 10mL时,有c(Na+)=2[c(HA-)+c(A2-)+c(H2A)]
D. 当V(NaOH)= 30mL时,2c(H+)+3c(H2A)+c(HA-)= 2c(OH-)+c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼系高温超导材料都具有良好的应用前景。回答下列问题:
(1)B的基态原子价电子排布式为____________________。BF3的立体构型是_____________________。
H3BO3为一元酸,与足量NaOH溶液反应得到[B(OH)4 ]-,[B(OH)4]-中B的杂化轨道类型为__________________________。
(2)NaBH4被认为是有机化学上的“万能还原剂”,NaBH4的电子式为_________________,其中三种元素的电负性由大到小的顺序是__________________________。
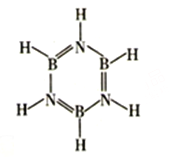
(3)硼与氮形成类似苯的化合物硼氮苯(B3N3H6),俗称无机苯(如图)。硼氮苯属于____________(填“极性”或“非极性”)分子,其间位上的二氯代物有______________种.
(4)NH4BF4 (氟硼酸铵)是合成氮化硼纳米管的原料之一。1mol NH4BF4含有_________mol 配位键。
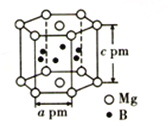
(5)硼与镁形成的高温超导材料晶体结构如图所示(B在六棱柱柱体内)。该六方晶胞中镁原子与硼原子的数量比为_____________,晶体密度d=_______________g·cm-3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素甲~戊在周期表中的相对位置如表所示,下面判断不正确的是( )
甲 | 乙 | |
丙 | 丁 | 戊 |
A.原子半径:丙>丁>戊
B.最外层电子数:甲>乙
C.金属性:甲<丙
D.氢氧化物碱性:丙>丁>戊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产硫酸需经过SO2的制造、SO2的催化氧化和SO3的吸收三个主要阶段,下列说法错误的是( )
A.废渣可做建材B.将矿石粉碎增大反应速率
C.尾气直接排放D.热交换器提高能量利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com