
【题目】化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)Zn﹣MnO2干电池应用广泛,其电解质溶液是ZnCl2﹣NH4Cl混合溶液。该电池的负极材料是______.电池工作时,电子流向______(填“正极”或“负极”)。
若ZnCl2﹣NH4Cl混合溶液中含有杂质Cu2+,会加速某电极的反应.其主要原因是_________________。
(2)铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为硫酸。该电池总反应式为:
Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
该蓄电池放电时,电解质溶液中阴离子移向_____________(填“正极”或“负极”);正极附近溶液的酸性_______(填“增强”、“减弱”或“不变”)放电时,负极的电极反应式为:________________。
(3)氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为KOH溶液,则氢氧燃料电池的负极反应式为_________________________________。该电池工作时,外电路每流过2 mole-,消耗标况下氧气____________L。
【答案】Zn(或锌) 正极 Zn与Cu2+反应生成Cu,Zn与Cu构成原电池,加快反应速率 负极 减弱 Pb - 2e- +SO42-=PbSO4 H2 - 2e- +2OH-= 2H2O(或 2H2 - 4e- +4OH-= 4H2O) 11.2
【解析】
(1)原电池的负极是发生氧化反应的一极:Zn-2e-===Zn2+;电池工作时,电子从负极流向正极;Zn与Cu2+发生氧化还原反应,生成的Cu附着在Zn的表面构成铜锌原电池,加快反应速率,从而加快Zn的腐蚀,故答案为:Zn(或锌);正极;锌与还原出来的铜构成铜-锌原电池而加快锌的腐蚀;
(2)铅蓄电池工作时,硫酸参加反应生成硫酸铅同时生成水,导致硫酸浓度降低、酸性减弱,原电池放电时阴离子向负极移动;放电时,铅为负极,失去电子被氧化,电极反应为:Pb - 2e- +SO42-=PbSO4;故答案为:负极、减弱、Pb - 2e- +SO42-=PbSO4;
(3)电解质溶液呈碱性,负极上氢气失电子生成水,则负极的电极方程式为2H2+4OH--4e-=4H2O;该电池中正极上是氧气发生得电子的还原反应,其电极反应为:O2+2H2O+4e-=4OH-,则外电路每流过2mol e-,消耗氧气为2mol÷4=0.5mol,所以氧气的体积为0.5mol×22.4L/mol=11.2L;故答案为:H2 - 2e- +2OH-= 2H2O(或 2H2 - 4e- +4OH-= 4H2O);11.2。


科目:高中化学 来源: 题型:
【题目】)某溶液中含有![]() 、
、![]() 、Cl三种阴离子,如果只取用一次该溶液(可以使用过滤操作),就能把三种离子依次检验出来:
、Cl三种阴离子,如果只取用一次该溶液(可以使用过滤操作),就能把三种离子依次检验出来:
(1)应该先检验_____离子,加入的试剂是稀硝酸,反应的离子方程式为:_____________;
(2)再检验_____离子,加入的试剂是_________,反应的离子方程式为:__________________;
(3)最后检验_____离子,加入的试剂是_________,反应的离子方程式为:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学要探究燃烧的条件和空气中氧气的含量,进行了如下实验。
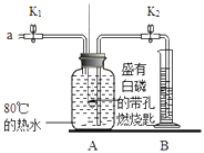
(实验)
①检查装置的气密性,气密性良好。
②向A瓶中加满80℃热水,将盛有白磷的带孔燃烧匙快速浸没热水中,塞紧瓶塞,白磷不燃烧。
③打开K1、K2,从a口向A瓶中鼓入空气,待瓶中的液面低于燃烧匙底部时,关闭K1、K2。此时进入量筒B中水的体积为200mL,观察到A瓶中的白磷燃烧。
(1)对比步骤②和③的现象可知,可燃物燃烧的条件之一是___;白磷燃烧的反应方程式为_____。
(2)待装置冷却一段时间后,打开K2,如果观察到____,说明空气中氧气的体积约占1/5。如何确定此装置气密性良好?(忽略燃烧匙位置漏气情况)______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把足量熟石灰放入蒸馏水中,一段时间后达到平衡:Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
Ca2+(aq)+2OH-(aq),下列叙述正确的是( )
A. 向溶液中加入少量的NaOH固体,则其中的Ca(OH)2的固体增多
B. 向溶液中加入Na2CO3溶液,则其中的Ca(OH)2的固体增多
C. 恒温下向溶液中加入CaO,溶液的pH升高
D. 给溶液加热,溶液的pH升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A. 根据一次能源和二次能源的划分,氢气为二次能源
B. 电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源
C. 火力发电是将燃料中的化学能直接转化为电能的过程
D. 在火力发电过程中,化学能转化为热能实际上是氧化还原反应发生的过程,伴随着能量的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种回收并利用含碘(I-)废液(废液中杂质沉淀后进入滤液中)的工艺流程如下:
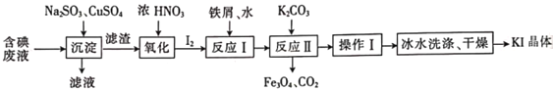
(1)“沉淀”后滤渣为______________________(填化学式,其中滤渣中Cu元素为+1价)
(2)“氧化”反应的离子方程式为______________________。
(3)反应I中只生成化合物FexIy(其中I与Fe的质量比为127︰21),反应中铁屑是___________(填“氧化剂”“还原剂”或“催化剂”,下同),水是___________。反应消耗的铁与转移电子的物质的量之比为___________。
(4)反应Ⅱ的化学方程式为_________________________________。
(5)操作I除蒸发皿、酒精灯外还需用到的玻璃仪器有______________________。冰水洗涤的目的是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温时HClO的Ka=3.0×10-8,HF的Ka=3.5×10-4。现将pH和体积都相同的次氯酸和氢氟酸溶液分别加蒸馏水稀释,pH随溶液体积的变化如图所示。下列叙述正确的是

A. 曲线I为次氯酸稀释时pH变化曲线
B. 取a点的两种酸溶液,中和相同体积、相同浓度的NaOH溶液,消耗次氯酸的体积较小
C. a点时,若都加入相同大小的锌粒,此时与氢氟酸反应的速率大
D. b点溶液中水的电离程度比c点溶液中水的电离程度小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气是重要的基本化工原料,广泛用于化学、冶金、造纸、纺织、医药、石油等工业,以及饮用水消毒、污水处理等方面。
(1)实验室制取Cl2的反应方程式为:4HCl(浓)+MnO2![]() Cl2↑+MnCl2+2H2O。该反应中氧化剂和还原剂物质的量之比为_________;
Cl2↑+MnCl2+2H2O。该反应中氧化剂和还原剂物质的量之比为_________;
(2)KMnO4和盐酸反应也可制取Cl2:
____KMnO4+____HCl=____KCl+____MnCl2+____Cl2↑+____H2O
请配平该反应方程式。当标准状况下有11.2L氯气生成时,该反应转移电子的数目为_____。
(3)用氯氧化法可处理含KCN的废水。液氯在碱性条件下可以将氰化物氧化成毒性仅为氰化物的千分之一的氰酸盐,氰酸盐再进一步被氧化为无毒物质。
①由反应KCN+2KOH+Cl2 = KOCN + 2KCl+H2O判断,氰酸盐KOCN中C元素的化合价为_________(已知反应前后氮元素化合价未改变);
②投入过量液氯,可将氰酸盐进一步氧化为氮气。请用单线桥法标出电子转移的方向和数目:
2KOCN+4KOH+ 3Cl2 = 2CO2↑ + N2 ↑+6KCl + 2H2O
______________________________
③若某厂废水中含KCN的浓度为0.65g/L,处理上述废水20.0 L,使KCN完全转化为无毒物质,至少需液氯的物质的量为___________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com