
【题目】第23号元素钒在地壳中的含量大约为0.009%,在过渡元素中仅次于Fe、Ti、Mn、Zn,排第五位。我国四川攀枝花地区蕴藏着极其丰富的钒钛磁铁矿。
(1)钒在周期表中的位置为__________,电子占据的最高能层的轨道形状为__________。
(2)在地壳中含量最高的五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数最多的是__________。
(3)过渡金属可形成许多羰基配合物,即CO作为配体形成的配合物。
①CO的等电子体有N2、CN-、__________(任写一个)等。
②CO作配体时,配位原子是C而不是O,其原因是__________。
(4)过渡金属配合物常满足“18电子规则”,即中心原子的价电子数加上配体提供的电子数之和等于18,如[Fe(CO)5]、[Mn(CO)5]-等都满足这个规则。
①下列钒配合物中,钒原子满足18电子规则的是__________。
A.[V(H2O)6]2+ B.[V(CN)6]4- C.[V(CO)6]- D.[V(O2)4]3-
②化合物 的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“
的熔点为138 ℃,其晶体类型为__________;已知该化合物满足18电子规则,其配体“![]() ”中的大π键可表示为__________。
”中的大π键可表示为__________。
(5)VCl2(熔点1027 ℃)和VBr2(熔点827 ℃)均为六方晶胞,结构如图所示。

①VCl2和VBr2两者熔点差异的原因是__________。
②设晶体中阴、阳离子半径分别为r-和r+,该晶体的空间利用率为__________(用含a、c、r+和r-的式子表示)。
【答案】 第四周期第VB族 球形 Mn NO+、![]() C的电负性小于O,对孤电子对吸引能力弱,给出电子对更容易 D 分子晶体
C的电负性小于O,对孤电子对吸引能力弱,给出电子对更容易 D 分子晶体 ![]() 两者均为离子晶体,Cl-半径小于Br-半径,VCl2中晶格能大于VBr2,故VCl2熔点高于VBr2
两者均为离子晶体,Cl-半径小于Br-半径,VCl2中晶格能大于VBr2,故VCl2熔点高于VBr2 ![]()
【解析】(1)钒是第23号元素,在周期表中的位置为第四周期第VB族;电子占据的最高能层的轨道是4s轨道,形状为球形;(2)五种过渡金属元素Fe、Ti、Mn、Zn、V中,基态原子核外单电子数分别为4、2、5、0、3,最多的是Mn;(3)等电子体指价电子数和原子数相同的分子、离子或基团,CO的等电子体有N2、CN-、NO+、![]() ;②CO作配体时,配位原子是C而不是O,其原因是C的电负性小于O,对孤电子对吸引能力弱,给出电子对更容易;(4)①A.[V(H2O)6]2+中V原子为21电子, B.[V(CN)6]4-中V原子为21电子,C.[V(CO)6]-中V原子为24电子D.[V(O2)4]3-中V原子满足18电子规则。答案选D;②化合物
;②CO作配体时,配位原子是C而不是O,其原因是C的电负性小于O,对孤电子对吸引能力弱,给出电子对更容易;(4)①A.[V(H2O)6]2+中V原子为21电子, B.[V(CN)6]4-中V原子为21电子,C.[V(CO)6]-中V原子为24电子D.[V(O2)4]3-中V原子满足18电子规则。答案选D;②化合物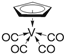 的熔点为138 ℃,低熔点,其晶体类型为分子晶体;已知该化合物满足18电子规则,其配体“
的熔点为138 ℃,低熔点,其晶体类型为分子晶体;已知该化合物满足18电子规则,其配体“![]() ”中的大π键5碳共用5电子,可表示为
”中的大π键5碳共用5电子,可表示为![]() ;(5)①两者均为离子晶体,Cl-半径小于Br-半径,VCl2中晶格能大于VBr2,故VCl2熔点高于VBr2;②晶体中阴、阳离子半径分别为r-和r+,晶胞的体积为
;(5)①两者均为离子晶体,Cl-半径小于Br-半径,VCl2中晶格能大于VBr2,故VCl2熔点高于VBr2;②晶体中阴、阳离子半径分别为r-和r+,晶胞的体积为![]() ,晶胞所占体积为
,晶胞所占体积为![]() ,该晶体的空间利用率为
,该晶体的空间利用率为![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】第ⅢA族的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)基态Ga原子价电子排布图为________.
(2)经测定发现,N2O5固体由NO2+和NO3-两种离子组成,该固体中N原子杂化类型为___;与NO2+互为等电子体的微粒有_____(写出一种)。
(3)铵盐大多不稳定,NH4F、NH4I中,较易分解的是_____,原因是______.
(4)第二周期中,第一电离能介于B元素和N元素之间的元素有______种。
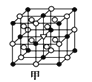
(5)晶体别有多种变体,但其基本结构单元都是由硼原子组成的正二十面体(见下图),每个顶点为一个硼原子,每个三角形均为等边三角形。若此结构单元为1个分子,则其分子式为____.

(6)冰晶石(Na3AlF6)由两种微粒构成,冰晶石的晶胞结构如图甲所示,●位于大立方体的顶点和面心,ο位于大立方体的12条棱的中点和8个小立方体的体心,那么大立方体的体心处所代表的微粒是_________ (填微粒符号)。
(7)A1单质的晶体中原子的堆积方式如图乙所示,其晶跑特征如图丙所示,原子之间相互位置关系的平面图如图丁所示:

若己知Al的原子半径为dnm,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目_____个;Al晶体的密度为_____g/cm3(用字母表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年科学家提出“绿色自由”构想。把含有大量CO2的空气吹入K2CO3溶液中,再把CO2从溶液中提取出来,并使之与H2反应生成可再生能源甲醇。其工艺流程如图所示:

(1)分解池中主要物质是_______________。(填化学式)
(2)在合成塔中,若有4400g CO2与足量H2反应,生成气态的H2O和甲醇,可放出5370kJ的热量,该反应的热化学方程式为_______________________________________。
(3)该工艺体现了“绿色自由”构想的“绿色”理念的方面有_______________________(任答一条)。
(4)一定条件下,往2 L恒容密闭容器中充入1mol CO2和3mol H2,在不同催化剂作用下发生反应I、反应II与反应III,相同时间内CO2的转化率随温度变化如下图所示:

(图中c点的转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是_________(填“反应I”、“反应II”、“反应III”)。同一种催化剂,温度越高,催化效果____(填“不变”、“增强”、“减弱”),分析其原因可能是_________(填字母)。
A.温度升高,平衡逆向移动 B.温度升高,催化剂失活
C.温度升高,催化剂脱附率增加 D.温度升高,平衡常数减小
②b点v(正)______v(逆)(填“>”、“<”或“=”)。
③若此反应在a点时已达平衡状态,a点的转化率比c点高的原因是__________。
④c点时该反应的平衡常数K=______。
(5)科学家还研究了其它转化温室气体的方法,利用下图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为___________________________,若导线中通过电子为a mol,则M极电解质溶液中H+改变量为________mol。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验操作、实验现象和所得结论均正确的是
实验操作 | 实验现象 | 结论 | |
A | 在2mL5%的H2O2溶液中加入1mL饱和FeCl3溶液 | 产生大量气泡 | Fe3+能催化H2O2的分解 |
B | 用0.100molL-1盐酸滴定未知浓度NaOH溶液(甲基橙做指示剂) | 溶液由橙色变红色,且在半分钟内不恢复 | 滴定到达终点 |
C | 向浓度均为0.1 mol·L-1NaCl 和NaI 混合溶液中滴加少量AgNO3溶液 | 产生黄色沉淀 | 溶度积: Ksp(AgCl)<Ksp(AgI) |
D | 往加有酚酞的碳酸钠溶液中加入足量的CaCl2溶液 | 产生白色沉淀,红色褪去 | 证明CO32-水解呈碱性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝广泛应用于电子陶瓷等工业领域。在一定条件下,AlN可通过以下反应合成:Al2O3+N2+3C![]() 2AlN+3CO。有关该反应下列叙述正确的是
2AlN+3CO。有关该反应下列叙述正确的是
A. 上述反应中,N2是还原剂,Al2O3是氧化剂
B. 上述反应中,每生成1 mol AlN需转移3 mol电子
C. AlN中氮的化合价为+3
D. AlN的摩尔质量为41 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)已知氢气在氧气中燃烧生成3.6g液态水放热57.16kJ的热量,请写出表示氢气燃烧热的热化学方程式___________________________;若断开H2(g)中1molH-H需要吸收436kJ的能量,生成H2O(g)中的1mol H-O键放出463 kJ的能量,18g液态水转化为水蒸气需要吸收44 kJ的能量,则断开1molO2中的共价键需要吸收___________kJ的能量。
(2)氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的正极反应式:___
(3)利用太阳能直接分解水制氢,是最具吸引力的制氢途径,其能量转化形式为_______
(4)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g)![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________
a.容器内气体压强保持不变
b. 1 mol MHx能够吸收ymol H2
c.若降温,该反应的平衡常数增大
d.若向容器内通入少量氢气,则c(H2)增大
(5)化工生产的副产氢也是氢气的来源。电解法制取有广泛用途的Na2FeO4,同时获得氢气:Fe+2H2O+2OH![]() FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。
FeO42+3H2↑,工作原理如图1所示。装置通电后,铁电极附近生成紫红色的FeO42,镍电极有气泡产生。若氢氧化钠溶液浓度过高,铁电极区会产生红褐色物质。已知:Na2FeO4只在强碱性条件下稳定,易被H2还原。

①请写出阳极电极反应式________________________
②电解过程中,须将阴极产生的气体及时排出,其原因是______________________
③c( Na2FeO4)随初始c(NaOH)的变化如图2,请分析在实验中控制NaOH浓度为14mol/L的原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2).一种以辉铜矿石为原料制备硝酸銅的工艺流程如下所示:

(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:_________。
(2)“矿渣”中除了S以外,还有_______(填化学式);“回收S”"过程中温度控制在50~60℃之间,不宜过高或过低的原因是_________ 。
(3)“保温除铁”过程中,加入CuO的目的是_________;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由是_________ 。
(4)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为________________;向“滤液M”"中加入(或通入)________ (填字母代号),可得到另一种流程中可循坏利用的物质。
A.铁 B.氯气 C.高锰酸钾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作正确的是( )
A.洗净的容量瓶可以放进烘箱中烘干
B.用磨口玻璃瓶保存NaOH溶液
C.用苯萃取溴水中的溴时,溴的苯溶液从分液漏斗的下口放出
D.用二硫化碳清洗残留在试管壁上少量的硫粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com