
有A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18.A原子核内仅有1个质子;D原子有两个电子层,最外层电子数是次外层电子数的3倍;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等; E元素的最外层电子数与A相同.
(1)写出C原子的原子结构示意图: 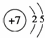 .
.
(2)标准状况下,11.2L BA4中含有电子数目为: 5NA .
(3)化合物E2D与ACD3反应的化学方程式(需用元素符号表示): Na2O+2HNO3=2NaNO3+H2O .
| 原子结构与元素的性质.. | |
| 专题: | 元素周期律与元素周期表专题. |
| 分析: | A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18,A原子核内仅有1个质子,则A为H元素; D原子有两个电子层,最外层电子数是次外层电子数的3倍,最外层电子数不超过8个,所以D为O元素; B原子的电子总数与D原子的最外层电子数相等,则B是C元素; A原子与B原子的最外层电子数之和与C原子的最外层电子数相等,C元素原子序数大于B而小于D,则C是N元素; E元素的最外层电子数与A相同,且原子序数大于D,所以E是Na元素, 再结合原子结构、物质性质分析解答. |
| 解答: | 解:A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18,A原子核内仅有1个质子,则A为H元素; D原子有两个电子层,最外层电子数是次外层电子数的3倍,最外层电子数不超过8个,所以D为O元素; B原子的电子总数与D原子的最外层电子数相等,则B是C元素; A原子与B原子的最外层电子数之和与C原子的最外层电子数相等,C元素原子序数大于B而小于D,则C是N元素; E元素的最外层电子数与A相同,且原子序数大于D,所以E是Na元素, (1)C为N元素,其原子核外有2个电子层、最外层电子数是5,其原子结构示意图为,故答案为:; (2)标准状况下,11.2L CH4的物质的量==0.5mol,每个甲烷分子中含有10个电子,所以电子总数为10×0.5mol×NA/mol=5NA,故答案为:5NA; (3)Na2O与HNO3反应生成硝酸钠和水,反应方程式为Na2O+2HNO3=2NaNO3+H2O,故答案为:Na2O+2HNO3=2NaNO3+H2O. |
| 点评: | 本题考查原子结构和性质,明确原子结构、元素周期表结构是解本题关键,熟练掌握前36号元素原子结构,知道常见10电子、18电子分子,题目难度不大. |


科目:高中化学 来源: 题型:
在给定条件下,下列划横线的物质在化学反应中能被完全消耗的是:( )
A. 标准状况下,将1 g铝片投入20 mL 18.4 mol·L-1的硫酸中
B. 向100 mL 3 moI·L-1的硝酸中加入5.6 g铁
C.用50 mL 18 mol·L-1浓硫酸与足量Cu共热(指其中的硫酸被完全消耗)
D.在5×107 Pa、500 ℃和铁触媒催化的条件下,用3 mol氢气和2 mol氮气合成氨
查看答案和解析>>
科目:高中化学 来源: 题型:
 在量热计中将100 mL 0.50 mol·L-1的CH3COOH溶液与100 mL 0.55 mol·L-1的NaOH溶液混合,温度从298.0 K升高至300.7 K。已知量热计的热容常数(量热计各部件每升高1 K所需要的热量)是150.5 J·K-1,溶液密度均为1 g·mL-1,生成溶液的比热容c=4.184 J·(g·K)-1。
在量热计中将100 mL 0.50 mol·L-1的CH3COOH溶液与100 mL 0.55 mol·L-1的NaOH溶液混合,温度从298.0 K升高至300.7 K。已知量热计的热容常数(量热计各部件每升高1 K所需要的热量)是150.5 J·K-1,溶液密度均为1 g·mL-1,生成溶液的比热容c=4.184 J·(g·K)-1。
(1)该反应的热化学方程式为 。
(2)在做中和反应的反应热的测定实验时,下列操作错误的是
A. 测量溶液的温度计要一直插在溶液中B. 为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸)
C. 为了使反应进行更完全,可以是酸(碱)适当过量
D. 若用KOH代替NaOH,对测定结果有影响。
(3) 你认为CH3COOH的中和热与HCl的中和热数值相比,________较大,其原因是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中的c (Cl ﹣)与100mL 1mol•L﹣1氯化铝溶液中的c (Cl﹣)相等( )
|
| A. | 300mL1mol•L﹣1 氯化钠溶液 | B. | 150mL2mol•L﹣1氯化铵溶液 |
|
| C. | 75mL3mol•L﹣1 氯化钙溶液 | D. | 10mL1.5mol•L﹣1 氯化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏伽德罗常数的值,下列说法中正确的 ( )
A.常温下,42 g C2H4和C4H8的混合物中含有的碳原子数为3 NA
B.58.5 g氯化钠固体中含有NA个氯化钠分子;
C.标况下,11.2 L己烷所含的分子数为0.5 NA;
D.1 mol FeCl3完全水解转化为氢氧化铁胶体后生成NA个胶粒;
查看答案和解析>>
科目:高中化学 来源: 题型:
下列依据热化学方程式得出的结论正确的是 ( ) ( )。
A.已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则氢气的燃烧热为241.8 kJ·mol-1
B. 已知NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1,则含40.0 g NaOH的稀溶液与稀醋酸完全中和,放出57.3 kJ的热量
C.已知2C(s)+2O2(g)===2CO2(g) ΔH=a;2C(s)+O2(g)===2CO(g) ΔH=b,则a>b
D.已知C(石墨,s)===C(金刚石,s) ΔH>0,则石墨比金刚石稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定的温度下,可逆反应A(g)+3B(g)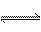 2C(g)达到平衡的标志是
2C(g)达到平衡的标志是
A.C分解速率与B生成速率相等 B.A、B、C的浓度不再变化
C.单位时间生成n mol A,同时生成3n mol B
D.A、B、C的分子数之比为132
查看答案和解析>>
科目:高中化学 来源: 题型:
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
⑴处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 。
⑵利用反应6NO2+ 8NH3 7N2+12 H2O处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为:___________________。
7N2+12 H2O处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为:___________________。
⑶降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0。该反应的
N2(g)+2CO2(g) △H<0。该反应的
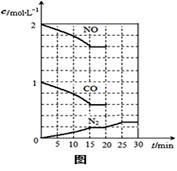 化学平衡常数表达式为K= ,该反应
化学平衡常数表达式为K= ,该反应
ΔS 0(填“>”或“ <”),若在一定温度下,将
2molNO、1molCO充入1L固定容积的容器中,反应过
程中各物质的浓度变化如右图所示。若保持温度不变,
20min时再向容器中充入CO、N2各0.6mol,平衡
将 移动(填“向左”、“向右”或“不”)。
20min时,若改变反应条件,导致N2浓度发生如图所示
的变化,则改变的条件可能是 (填序号)。
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
⑷利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com