
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
⑴处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 。
⑵利用反应6NO2+ 8NH3 7N2+12 H2O处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为:___________________。
7N2+12 H2O处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为:___________________。
⑶降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0。该反应的
N2(g)+2CO2(g) △H<0。该反应的
 化学平衡常数表达式为K= ,该反应
化学平衡常数表达式为K= ,该反应
ΔS 0(填“>”或“ <”),若在一定温度下,将
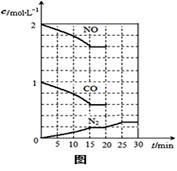
2molNO、1molCO充入1L固定容积的容器中,反应过
程中各物质的浓度变化如右图所示。若保持温度不变,
20min时再向容器中充入CO、N2各0.6mol,平衡
将 移动(填“向左”、“向右”或“不”)。
20min时,若改变反应条件,导致N2浓度发生如图所示
的变化,则改变的条件可能是 (填序号)。
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
⑷利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
有A、B、C、D、E五种元素,它们原子的核电荷数依次递增且均小于18.A原子核内仅有1个质子;D原子有两个电子层,最外层电子数是次外层电子数的3倍;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子的最外层电子数之和与C原子的最外层电子数相等; E元素的最外层电子数与A相同.
(1)写出C原子的原子结构示意图: 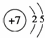 .
.
(2)标准状况下,11.2L BA4中含有电子数目为: 5NA .
(3)化合物E2D与ACD3反应的化学方程式(需用元素符号表示): Na2O+2HNO3=2NaNO3+H2O .
查看答案和解析>>
科目:高中化学 来源: 题型:
某烃有两种或两种以上的同分异构体,其同分异构体中的某一种的一氯代物只有一种则这种烃可能是( )
①分子中具有7个碳原子的芳香烃 ②分子中具有4个碳原子的烷烃 ③分子中具有12个氢原子的烷烃 ④分子中具有6个碳原子的烷烃 ⑤分子中具有8个碳原子的烷烃
A. ①②③ B. ③⑤ C. ③④⑤ D. ②③④⑤
Ⅱ(8分)有机物A由碳、氢、氧三种元素组成。现取2.3 g A与2.8 L氧气(标准状况)在密闭容器中燃烧,燃烧后生成二氧化碳、一氧化碳和水蒸气(假设反应物没有剩余)。将反应生成的气体依次通过浓硫酸和碱石灰,浓硫酸增重2.7 g,碱石灰增重2.2 g。回答下列问题:
(1)2.3 g A中所含氢原子、碳原子的物质的量各是多少?
(2)通过计算确定该有机物的分子式;
(3)试写出该有机物可能的结构简式.
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下发生反应2A(g)+2B(g)  xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,测得反应速率v(D)=0.2mol/(L·min),下列说法正确的是
xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,测得反应速率v(D)=0.2mol/(L·min),下列说法正确的是
A.A和B的转化率均是20% B.x = 4
C.平衡时A的物质的量为2.8mol D.平衡时气体压强比原来减小
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,在一个2L的密闭容器中,加入4molA和2molB进行如下反应:
3A(g)+2B(g) 4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是
4C(?)+2D(?),反应一段时间后达到平衡,测得生成1.6molC,且反应的前后压强之比为5:4(相同的温度下测量),则下列说法正确的是
A.该反应的化学平衡常数表达式是K=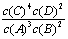
B.此时,B的平衡转化率是35%
C.增大该体系的压强,平衡向右移动,化学平衡常数增大
D.增加一定物质的量的C,B的平衡转化率不变
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.相同条件下,N2和O3混合气体与等体积的N2所含的原子数相同
B.等物质的量的CH4和OH—所含电子数相等
C.常温常压下,28g CO与22.4L O2所含分子数相等
D.16g CH4与18g NH4+所含质子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.石灰水与过量碳酸氢钠溶液反应:HCO3-+Ca2++OH-===CaCO3↓+H2O
B.硫酸氢钠溶液中加入氢氧化钡溶液至中性:2H++SO42—+Ba2++2OH-===BaSO4↓+2H2O
C.氧化铜与稀硫酸反应:2H++O2-===H2O
D.碳酸氢钠溶液中加入盐酸:CO32—+2H+===CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.标准状况下,22.4 L 苯中含有NA个苯分子
B.1 mol/L NaCl溶液含有NA个Na+
C.1 mol Fe和足量稀硝酸反应产生22.4LNO
D.16 g CH4中含有4 NA个C—H键
查看答案和解析>>
科目:高中化学 来源: 题型:
反应mA(g)+nB(g)⇌pC(g)+qD(g),经5min后达到平衡,测得此时A的浓度减少了a mol/L,同时C的浓度增加了2a/3mol/L,又测得平均反应速率v(C)=2v(B).达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为
( )
|
| A. | 2A(g)+6B(g)⇌3C(g)+5D(g) | B. | 3A(g)+B(g)⇌2C(g)+2D(g) | C. | 3A(g)+B(g)⇌2C(g)+D(g) | D. | A(g)+3B(g)⇌2C(g)+2D(g) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com