
反应mA(g)+nB(g)⇌pC(g)+qD(g),经5min后达到平衡,测得此时A的浓度减少了a mol/L,同时C的浓度增加了2a/3mol/L,又测得平均反应速率v(C)=2v(B).达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为
( )
|
| A. | 2A(g)+6B(g)⇌3C(g)+5D(g) | B. | 3A(g)+B(g)⇌2C(g)+2D(g) | C. | 3A(g)+B(g)⇌2C(g)+D(g) | D. | A(g)+3B(g)⇌2C(g)+2D(g) |
| 化学平衡的计算. . | |
| 专题: | 化学平衡专题. |
| 分析: | 利用速率之比等于化学计量数之比、浓度变化量之比等于化学计量数之比,确定m、n、p的关系,平衡后,若保持温度不变,给体系加压,平衡不移动,故反应前后气体的物质的量不变,据此确定q,进而确定m、n、p、q关系,据此判断. |
| 解答: | 解:A的浓度减少了a mol/L,同时C的浓度增加了2a/3mol/L,则m:p=amol/L: 平均反应速率v(C)=2v(B),故v(C):v(B):v(C)=n:p=1:2,故m:n:p=3:1:2, 平衡后,若保持温度不变,给体系加压,平衡不移动,故反应前后气体的物质的量不变,即m+n=p+q,故3+1=2+q,故q=2,所以m:n:p:q=3:1:2:2, 故选B. |
| 点评: | 本题考查化学反应速率的有关计算、化学平衡移动影响等,难度不大,明确速率之比=化学计量数之比=浓度变化量之比=物质的量变化量之比,判断反应前后气体的物质的量不变是解题关键. |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
随着大气污染的日趋严重,国家拟于“十二五”期间,将二氧化硫(SO2)排放量减少8%,氮氧化物(NOx)排放量减少10%。目前,消除大气污染有多种方法。
⑴处理NOx的一种方法是利用甲烷催化还原NOx。已知:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
则甲烷直接将NO2还原为N2的热化学方程式为 。
⑵利用反应6NO2+ 8NH3 7N2+12 H2O处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为:___________________。
7N2+12 H2O处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。NO2也可用NaOH溶液吸收,生成两种盐,该反应的化学方程式为:___________________。
⑶降低汽车尾气的方法之一是在排气管上安装催化转化器,发生如下反应:
2NO(g)+2CO(g) N2(g)+2CO2(g) △H<0。该反应的
N2(g)+2CO2(g) △H<0。该反应的
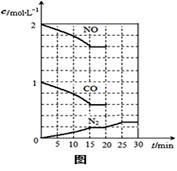 化学平衡常数表达式为K= ,该反应
化学平衡常数表达式为K= ,该反应
ΔS 0(填“>”或“ <”),若在一定温度下,将
2molNO、1molCO充入1L固定容积的容器中,反应过
程中各物质的浓度变化如右图所示。若保持温度不变,
20min时再向容器中充入CO、N2各0.6mol,平衡
将 移动(填“向左”、“向右”或“不”)。
20min时,若改变反应条件,导致N2浓度发生如图所示
的变化,则改变的条件可能是 (填序号)。
①加入催化剂 ②降低温度 ③缩小容器体积 ④增加CO2的量
⑷利用Fe2+、Fe3+的催化作用,常温下将SO2转化为SO42-而实现SO2的处理(总反应为2SO2+O2+2H2O=2H2SO4)。已知,含SO2的废气通入含Fe2+、Fe3+的溶液时,其中一个反应的离子方程式为4Fe2+ + O2+ 4H+ = 4Fe3+ + 2H2O,则另一反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
将SO2气体与足量Fe2(SO4)3溶液完全反应后,再加入K2Cr2O7溶液,发生如下两个化学反应:下列有关说法不正确的是 ( )
①SO2+2Fe3++2H2O===SO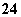 +2Fe2++4H+
+2Fe2++4H+
②Cr2O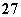 +6Fe2++14H+===2Cr3++6Fe3++7H2O
+6Fe2++14H+===2Cr3++6Fe3++7H2O
A.氧化性Cr2O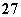 >Fe3+>SO2
>Fe3+>SO2
B.Cr2O 能将Na2SO3氧化成Na2SO4
能将Na2SO3氧化成Na2SO4
C.若33.6LSO2(标准状况)参加反应,则最终消耗K2Cr2O7 0.5mol
D.每反应1molK2Cr2O7 ,转移电子3 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学——物质结构与性质]
近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
(1)铬元素的基态原子的价电子层排布式是 。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 |
(3)Mn和Fe的部分电离能数据如表:
根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(4)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。
某镍配合物结构如右图所示,分子内含有的作用力
 有 (填序号)。
有 (填序号)。
A.氢键 B.离子键 C.共价键
D.金属键 E.配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是 。
 (5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。
试推测:四羰基镍的晶体类型是
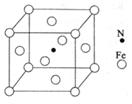
(6)铁能与氮形成一种磁性材料,其晶胞结构如右图所示,
则该磁性材料的化学式为
查看答案和解析>>
科目:高中化学 来源: 题型:
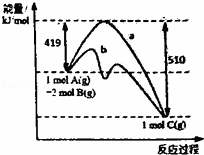
反应A(g)+2B(g)=C(g)的反应过程中能量变化如图所示.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.下列相关说法正确的是( )
|
| A. | 该反应是吸热反应 | B. | 催化剂改变了该反应的焓变 |
|
| C. | 催化剂降低了该反应的活化能 | D. | 该反应的焓变△H=﹣510kJ.mo1﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
为了说明影响化学反应速率快慢的因素,甲、乙、丙、丁四位同学分别设计了如下A﹣D四个实验,你认为结论不正确的是( )
|
| A. | 将铜片放入稀硫酸中,无现象.若再向所得溶液中加入硝酸银溶液,一段时间后,由于形成原电池,可看到有氢气生成 |
|
| B. | 将表面积、质量都相同的镁条和铝条分别与同浓度的盐酸反应,前者速率大于后者 |
|
| C. | 两支试管中分别加入相同质量的氯酸钾,其中一支试管中再加入少量二氧化锰,同时加热,产生氧气的快慢不同 |
|
| D. | 相同条件下等质量的块状和粉末状大理石分别与相同浓度的盐酸反应时,粉末状的反应速率快 |
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,若 N2、H2、NH3起始浓度分别为c1、c2、c3(均不为0),当达平衡时N2、H2、NH3的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
|
| A. | c1:c2=1:3 |
|
| B. | N2、H2的转化率不相等 |
|
| C. | 平衡时,H2和NH3的生成速率之比为3:2 |
|
| D. | c1的取值范围为0<c1<0.14 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
在酸性溶液中,高锰酸钾发生的反应是MnO +5e-+8H+===Mn2++4H2O。下列离子能让此反应过程发生的是 ( )
+5e-+8H+===Mn2++4H2O。下列离子能让此反应过程发生的是 ( )
①Fe2+ ②C2O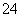 ③SiO
③SiO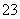 ④IO
④IO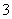
A.①② B.①③
C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.反应NH3(g) + HCl(g) = NH4Cl(s) △H < 0,在任何条件下均能自发进行
B.铅蓄电池在放电过程中,负极质量减小,正极质量增加
C.外加电流的阴极保护法中,待保护金属作阴极
D.电镀工业中,待镀金属作阳极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com