
下列叙述正确的是
A.反应NH3(g) + HCl(g) = NH4Cl(s) △H < 0,在任何条件下均能自发进行
B.铅蓄电池在放电过程中,负极质量减小,正极质量增加
C.外加电流的阴极保护法中,待保护金属作阴极
D.电镀工业中,待镀金属作阳极
 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案科目:高中化学 来源: 题型:
反应mA(g)+nB(g)⇌pC(g)+qD(g),经5min后达到平衡,测得此时A的浓度减少了a mol/L,同时C的浓度增加了2a/3mol/L,又测得平均反应速率v(C)=2v(B).达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为
( )
|
| A. | 2A(g)+6B(g)⇌3C(g)+5D(g) | B. | 3A(g)+B(g)⇌2C(g)+2D(g) | C. | 3A(g)+B(g)⇌2C(g)+D(g) | D. | A(g)+3B(g)⇌2C(g)+2D(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是( )
A. 乙酸的结构简式: C2H4O2 B. F-的结构示意图: 
C. 中子数为20 的氯原子: 2017Cl D. NH3 的电子式: 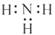
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
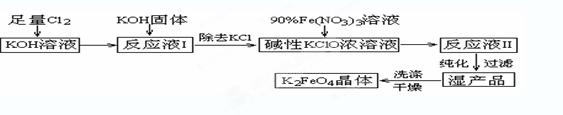
已知:① 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH → 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为 ;
(5)在“反应液I”中加KOH固体的目的是 :
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,会有副产品 (写化学
式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,体积为10 L的密闭容器中,1molX和1molY进行反应:
2X(g)+Y(g)  Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A.以X浓度变化表示的反应速率为0.001mol/(L·S)
B.将容器体积变为20L,Z的平衡浓度变为原来的一半
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下存在反应:C(s)+H2O(g) CO(g)+H2(g) △H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
CO(g)+H2(g) △H>0。向甲、乙、丙三个恒容容器中加入一定量C和H2O,各容器中温度、反应物的起始量如下表,反应过程中CO的物质的量浓度随时间变化如图所示。
| 容器 | 甲 | 乙 | 丙 |
| 容积 | 0.5 L | 0.5 L | V |
| 温度 | T1 ℃ | T2 ℃ | T1 ℃ |
| 起始量 | 2 molC 1 molH2O | 1 molCO 1 molH2 | 4 molC 2 molH2O |
下列说法正确的是
A.甲容器中,反应在前15 min的平均速率v(H2)=0.1 mol·L-1·min-1
B.丙容器的体积V<0.5 L
C.当温度为T1 ℃时,反应的平衡常数K=2.25
D.乙容器中,若平衡时n(H2O)=0.4 mol,则T1< T2

查看答案和解析>>
科目:高中化学 来源: 题型:
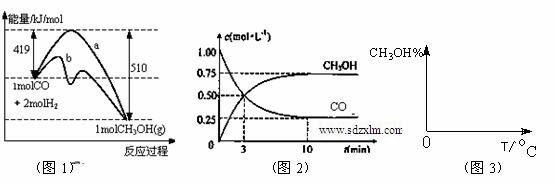
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
请回答下列问题:
(1)在“图1”中,曲线 (填:a或b)表示使用了催化剂;该反应的逆反应属于 (填:吸热、放热)反应。
(2)下列说法正确的是
A.起始充入的CO为2mol B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小
(3)从反应开始到建立平衡, v(H2)= ;该温度下CO(g)+2H2(g)  CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数 (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数 (填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重124 g,则某气体的相对分子质量为( )
A.48 B. 28 C.32 D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入过量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是( )
A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g
B.若向该溶液中加入过量的稀硫酸,产生的气体遇空气能变成红棕色
C.若向该溶液中加入过量的稀硫酸和KSCN溶液,溶液显血红色
D.该溶液中所含的离子是:Fe2+、Na+、SO42-、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com