
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
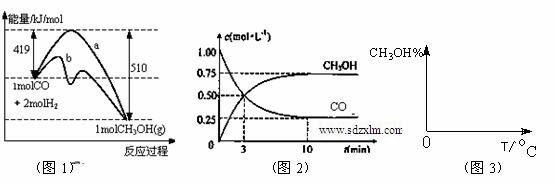
请回答下列问题:
(1)在“图1”中,曲线 (填:a或b)表示使用了催化剂;该反应的逆反应属于 (填:吸热、放热)反应。
(2)下列说法正确的是
A.起始充入的CO为2mol B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小
(3)从反应开始到建立平衡, v(H2)= ;该温度下CO(g)+2H2(g)  CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数 (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数 (填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
科目:高中化学 来源: 题型:
一定条件下,若 N2、H2、NH3起始浓度分别为c1、c2、c3(均不为0),当达平衡时N2、H2、NH3的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是( )
|
| A. | c1:c2=1:3 |
|
| B. | N2、H2的转化率不相等 |
|
| C. | 平衡时,H2和NH3的生成速率之比为3:2 |
|
| D. | c1的取值范围为0<c1<0.14 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )
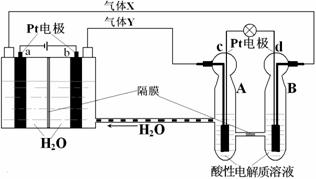 A.转移0.1mol电子时,a电极产生1.12LH2(标准状况)
A.转移0.1mol电子时,a电极产生1.12LH2(标准状况)
B.b电极上发生的电极反应是:
2H2O+2e-=H2↑+2OH-
C.c电极上进行还原反应,B电池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.反应NH3(g) + HCl(g) = NH4Cl(s) △H < 0,在任何条件下均能自发进行
B.铅蓄电池在放电过程中,负极质量减小,正极质量增加
C.外加电流的阴极保护法中,待保护金属作阴极
D.电镀工业中,待镀金属作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
最新研制的一种由甲醇和氧气以及强碱作电解质溶液的新型手机电池。下列有关此
电池的叙述错误的是
A.正极电极反应: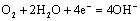
B.负极电极反应: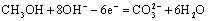
C.电池在使用过程中电解质溶液的pH降低
D.当外电路通过0.6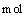 电子时,理论上消耗甲醇6.4g
电子时,理论上消耗甲醇6.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
下列的分离方法正确的是( )
A.用萃取的方法除去花生油中的水份
B.用过滤的方法除去NaCl溶液中含有的少量淀粉
C.用酒精萃取碘水中的碘
D.用蒸馏的方法除去水中的不挥发的杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中溶质的物质的量浓度为1 mol/L的是( )
A.将40 g NaOH溶解于1 L水中配成的NaOH溶液
B.常温常压下将22.4 L HCl 气体溶于水配成1 L的盐酸溶液
C.将1 L 10 mol/L的浓盐酸与9L水混合配成溶液
D.从1000 mL 1 mol/L NaCl溶液中取出100 mL的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验或实验操作达到实验目的的是( )

A.图I:将海带灼烧成灰
B.图II:检验装置的气密性
C.图III:制取少量纯净的CO2气体
D.图IV:蒸干NH4Cl饱和溶液制备NH4Cl晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
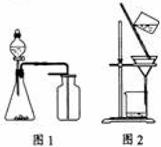
下列有关实验原理或操作正确的是 ( )
A.选择合适的试剂,用图1所示装置可分别制取收集少量 CO2、NO、O2
B.配制FeSO4溶液时,一般加一定量稀硫酸和足量铁粉,并且现配现用
C.洗涤沉淀时(见图2),向漏斗中加适量水,搅拌并滤干
D.用干燥的pH试纸可测得新制氯水的pH=2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com