
下列溶液中溶质的物质的量浓度为1 mol/L的是( )
A.将40 g NaOH溶解于1 L水中配成的NaOH溶液
B.常温常压下将22.4 L HCl 气体溶于水配成1 L的盐酸溶液
C.将1 L 10 mol/L的浓盐酸与9L水混合配成溶液
D.从1000 mL 1 mol/L NaCl溶液中取出100 mL的溶液
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.摩尔质量就等于物质的相对分子质量
B.摩尔质量就是物质相对分子质量的6.02×1023倍
C.HNO3的摩尔质量是63g
D.硫酸和磷酸的摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,体积为10 L的密闭容器中,1molX和1molY进行反应:
2X(g)+Y(g)  Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是
A.以X浓度变化表示的反应速率为0.001mol/(L·S)
B.将容器体积变为20L,Z的平衡浓度变为原来的一半
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的△H>0
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g) CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
CH3OH(g)。图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化。
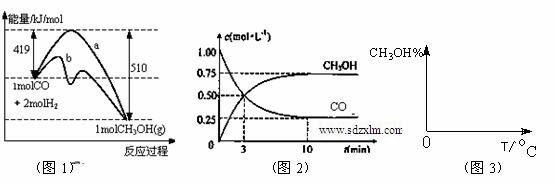
请回答下列问题:
(1)在“图1”中,曲线 (填:a或b)表示使用了催化剂;该反应的逆反应属于 (填:吸热、放热)反应。
(2)下列说法正确的是
A.起始充入的CO为2mol B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2,再次达到平衡时n(CH3OH)/n(CO)会减小
(3)从反应开始到建立平衡, v(H2)= ;该温度下CO(g)+2H2(g)  CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数 (填“增大”、“减小”或“不变”)。
CH3OH(g)的化学平衡常数为 。若保持其它条件不变,将反应体系升温,则该反应化学平衡常数 (填“增大”、“减小”或“不变”)。
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2,且P1<P2)。
(5)已知CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g) ΔH=-192.9kJ/mol
又知H2O(l)= H2O(g) ΔH=+44 kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重124 g,则某气体的相对分子质量为( )
A.48 B. 28 C.32 D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中正确的是( )
A.干冰、液态氯化氢都是电解质
B.Na2O2晶体中既含有离子键又含有共价键
C.Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物
D.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
在下列溶液中,能大量共存的离子组是( )
A.能使pH试纸显蓝色的溶液中:K+、Ba2+、Cl-、Br-
B.常温下PH=1的溶液中:Fe2+、Mg2+、NO 、Cl-
、Cl-
C.含有大量Fe3+的溶液中:SCN-、I-、K+、Br-
D.能使石蕊试液显红色的溶液中:K+、 、S2-、
、S2-、
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质按照纯净物、化合物、强电解质、弱电解质和非电解质顺序排列的是
A.纯盐酸、水煤气、硫酸、醋酸、干冰
B.聚氯乙烯、漂白粉、苛性钠、氢硫酸、三氧化硫
C.冰醋酸、福尔马林、硫酸钡、氢氟酸、氯气
D.冰水混合物、胆矾、氯化钾、次氯酸、乙醇
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com