
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
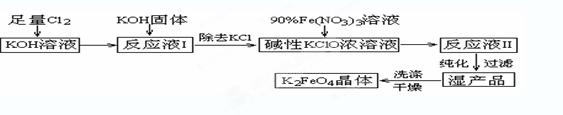
已知:① 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH → 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为 ;
(5)在“反应液I”中加KOH固体的目的是 :
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,会有副产品 (写化学
式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
科目:高中化学 来源: 题型:
[化学——物质结构与性质]
近现代战争中,制造坦克战车最常用的装甲材料是经过轧制和热处理后的合金钢,热处理后整个装甲结构的化学和机械特性和最大限度的保持一致。钢中合金元素的百分比含量为:铬0.5~1.25 镍0.5~1.5 钼0.3~0.6 锰0.8~1.6 碳0.3
(1)铬元素的基态原子的价电子层排布式是 。
(2)C元素与其同主族下一周期元素组成的晶体中,C原子的杂化方式为 .
| 元 素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 |
(3)Mn和Fe的部分电离能数据如表:
根据表数据,气态Mn2+再失去一个电子比气态Fe2+再失去一个电子难,其原因是 。
(4)镍(Ni)可形成多种配合物,且各种配合物有广泛的用途。
某镍配合物结构如右图所示,分子内含有的作用力
 有 (填序号)。
有 (填序号)。
A.氢键 B.离子键 C.共价键
D.金属键 E.配位键
组成该配合物分子且同属第二周期元素的电负性由大到小的顺序是 。
 (5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。
(5)金属镍粉在CO气流中轻微加热,生成无色挥发性液态Ni(CO)4,呈四面体构型。423K时,Ni(CO)4分解为Ni和CO,从而制得高纯度的Ni粉。
试推测:四羰基镍的晶体类型是
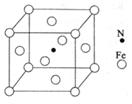
(6)铁能与氮形成一种磁性材料,其晶胞结构如右图所示,
则该磁性材料的化学式为
查看答案和解析>>
科目:高中化学 来源: 题型:
在酸性溶液中,高锰酸钾发生的反应是MnO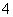 +5e-+8H+===Mn2++4H2O。下列离子能让此反应过程发生的是 ( )
+5e-+8H+===Mn2++4H2O。下列离子能让此反应过程发生的是 ( )
①Fe2+ ②C2O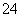 ③SiO
③SiO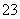 ④IO
④IO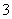
A.①② B.①③
C.②③ D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是( )
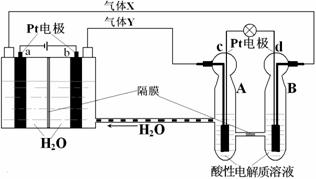 A.转移0.1mol电子时,a电极产生1.12LH2(标准状况)
A.转移0.1mol电子时,a电极产生1.12LH2(标准状况)
B.b电极上发生的电极反应是:
2H2O+2e-=H2↑+2OH-
C.c电极上进行还原反应,B电池中的H+可以通过隔膜进入A池
D.d电极上发生的电极反应是:O2+4H++4e-=2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度下,H2(g)+CO2(g)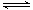 H2O(g)+CO(g)的平衡常数K=
H2O(g)+CO(g)的平衡常数K=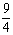 。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
。该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如下表所示。
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
下列判断不正确的是
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 mol/L
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是
A.反应NH3(g) + HCl(g) = NH4Cl(s) △H < 0,在任何条件下均能自发进行
B.铅蓄电池在放电过程中,负极质量减小,正极质量增加
C.外加电流的阴极保护法中,待保护金属作阴极
D.电镀工业中,待镀金属作阳极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列的分离方法正确的是( )
A.用萃取的方法除去花生油中的水份
B.用过滤的方法除去NaCl溶液中含有的少量淀粉
C.用酒精萃取碘水中的碘
D.用蒸馏的方法除去水中的不挥发的杂质
查看答案和解析>>
科目:高中化学 来源: 题型:
水溶液X中只可能溶有K+、Mg2+、Al3+、AlO2-、SiO32- 、SO32-、CO32- 、SO42-中的若干种离子。某同学对该溶液进行了如下实验:

下列判断错误的是( )
A.气体甲可能是混合物
B.沉淀甲是硅酸和硅酸镁的混合物
C.白色沉淀乙的主要成分是氢氧化铝[学科
D.K+、AlO2-和SiO32-一定存在于溶液X中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com