
在酸性溶液中,高锰酸钾发生的反应是MnO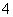 +5e-+8H+===Mn2++4H2O。下列离子能让此反应过程发生的是 ( )
+5e-+8H+===Mn2++4H2O。下列离子能让此反应过程发生的是 ( )
①Fe2+ ②C2O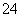 ③SiO
③SiO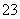 ④IO
④IO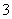
A.①② B.①③
C.②③ D.③④
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.标准状况下,22.4 L 苯中含有NA个苯分子
B.1 mol/L NaCl溶液含有NA个Na+
C.1 mol Fe和足量稀硝酸反应产生22.4LNO
D.16 g CH4中含有4 NA个C—H键
查看答案和解析>>
科目:高中化学 来源: 题型:
反应mA(g)+nB(g)⇌pC(g)+qD(g),经5min后达到平衡,测得此时A的浓度减少了a mol/L,同时C的浓度增加了2a/3mol/L,又测得平均反应速率v(C)=2v(B).达到平衡后,若保持温度不变,给体系加压,平衡不移动,那么该反应可表示为
( )
|
| A. | 2A(g)+6B(g)⇌3C(g)+5D(g) | B. | 3A(g)+B(g)⇌2C(g)+2D(g) | C. | 3A(g)+B(g)⇌2C(g)+D(g) | D. | A(g)+3B(g)⇌2C(g)+2D(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某气体反应的平衡常数可表示为K=c(CH3OCH3)c(H2O)/[c(CH3OH)]2,该反应在不同温度下的平衡常数:400℃,K=32;500℃,K=44.
请回答下列问题:
(1)写出上述反应的化学方程式 2CH3OH(g)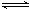 CH3OCH3(g)+H2O(g) .
CH3OCH3(g)+H2O(g) .
(2)该反应的正反应是 吸热 反应(填“放热”或者“吸热”),
(3)已知在密闭容器中,测得某时刻各组分的浓度如下:
| 物质 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 浓度/(mol•L﹣1) | 0.54 | 0.68 | 0.68 |
①此时系统温度400℃,比较正、逆反应速率的大小:v正 > v逆 (填“>”、“<”或“=”).
②若以甲醇百分含量为纵坐标,以温度为横坐标,此时反应点在图象的位置是图中 A 点.比较图中B、D两点所对应的正反应速率B < D(填“>”、“<”或“=”).理由是 D点温度高于B点,温度越高反应速率越大,所以反应速率也大于B .
(4)一定条件下要提高反应物的转化率,可以采用的措施是 ae
a.升高温度 b.加入催化剂 c.压缩容器的体积
d.增加水蒸气的浓度 e.及时分离出产物.

查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.摩尔质量就等于物质的相对分子质量
B.摩尔质量就是物质相对分子质量的6.02×1023倍
C.HNO3的摩尔质量是63g
D.硫酸和磷酸的摩尔质量相等
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A、B、C为中学化学中常见单质。室温下,A为固体,B和C均为气体。在适宜的条件下,它们有如图所示的转化关系。
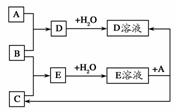
回答下列问题。
(1)A、B、C三种单质的组成元素中的任意两种形成的化合物所属物质类别一定不是________。
①氢化物 ②酸 ③碱 ④盐 ⑤氧化物
理由是______________________________________________________。
(2)A、B、C中有一种是金属,则三种单质中可能是金属的是________,理由是____________________________________________________________。
(3)如果E溶液是一种强酸,写出E作为还原剂参加反应的离子方程式:_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语表示正确的是( )
A. 乙酸的结构简式: C2H4O2 B. F-的结构示意图: 
C. 中子数为20 的氯原子: 2017Cl D. NH3 的电子式: 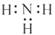
查看答案和解析>>
科目:高中化学 来源: 题型:
高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
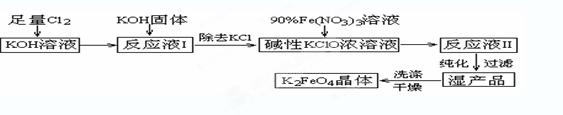
已知:① 2KOH + Cl2 → KCl + KClO + H2O(条件:温度较低)
② 6KOH + 3Cl2 → 5KCl + KClO3 + 3H2O(条件:温度较高)
③ 2Fe(NO3)3 + 2KClO + 10KOH → 2K2FeO4 + 6KNO3 + 3KCl + 5H2O
回答下列问题:
(1)该生产工艺应在 (填“温度较高”或“温度较低”)情况下进行;
(2)写出工业上制取Cl2的化学方程式 ;
(3)K2FeO4具有强氧化性的原因 ;
(4)配制KOH溶液时,是在每100 mL水中溶解61.6 g KOH固体(该溶液的密度为1.47 g/mL),它的物质的量浓度为 ;
(5)在“反应液I”中加KOH固体的目的是 :
A.与“反应液I”中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供反应物
D.使副产物KClO3转化为 KClO
(6)从“反应液II”中分离出K2FeO4后,会有副产品 (写化学
式),它们都是重要的化工产品,具体说出其中一种物质的用途 。
查看答案和解析>>
科目:高中化学 来源: 题型:
同温同压下,某容器充满O2重116 g,若充满CO2重122 g,现充满某气体重124 g,则某气体的相对分子质量为( )
A.48 B. 28 C.32 D.4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com